Guías de Prácticas Clínicas
Infarto agudo de miocardio con elevacion del segmento ST. Guía de Práctica Clínica
ST-segment Elevation Acute Myocardial Infarction. Clinical Practice Guideline
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2021-07-23 13:14:30
Aprobado: 2022-08-14 17:18:13
Correspondencia: Francisco de Jesús Valladares Carvajal. Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos. valladares@gal.sld.cu
RESUMEN
Palabras clave: infarto del miocardio con elevación del segmento st; guía de práctica clínica; cumplimiento y adherencia al tratamiento
ABSTRACT
Key words: st elevation myocardial infarction; practice guideline; treatment adherence and compliance
INTRODUCCIÓN
Las Guías de Práctica Clínica (GPC) tienen como objetivo presentar toda la evidencia relevante sobre un tema específico para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular que sufre una determinada enfermedad.(1)
La implementación de las GPC, con intervenciones eficaces basadas en la evidencia, ha mejorado los resultados del manejo de pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) en países de altos ingresos, sin embargo, no ocurre lo mismo en países con medianos y bajos ingresos, donde existen grandes brechas en su implementación, debido a múltiples factores.(2)
La presente Guía de Práctica Clínica (GPC) se refiere a los pacientes que presentan síntomas isquémicos o sus equivalentes y una elevación persistente del segmento ST en el electrocardiograma. Esta guía no aborda los elementos relacionados directamente con los procedimientos de intervencionismo coronario percutáneo (ICP) ni la revascularización miocárdica quirúrgica (RMQuir).
La mayoría de las recomendaciones se han acotado teniendo en cuenta los grados de recomendación y los niveles de evidencia, formulados en las GPC revisadas.(1,2,3)
Grados de recomendación:
Clase I: evidencia y/o acuerdo general de que un determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo. Se recomienda, está indicado.
Clase II: evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento.
- Clase IIa: el peso de la evidencia/opinión está a favor de la utilidad/eficacia. Se debe considerar.
- Clase IIb: la utilidad/eficacia está menos establecida por la evidencia/opinión. Se puede considerar.
Clase III: evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial. No se recomienda.
Niveles de evidencia
Nivel de evidencia A: datos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis.
Nivel de evidencia B: datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados.
Nivel de evidencia C: consenso de opinión de expertos y/o pequeños estudios, práctica convencional.
Objetivos
El objetivo principal de esta GPC es optimizar el proceso de diagnóstico y tratamiento de los pacientes con IAMCEST en la provincia Cienfuegos.
Sus principales usuarios son los médicos pertenecientes a las unidades que tienen a su cargo la atención (tanto prehospitalaria como hospitalaria), de pacientes con IAMCEST, es decir, médicos generales integrales, intensivistas, internistas y cardiólogos (especialistas y residentes).
DESARROLLO
1.1 Definición y Clasificación
El infarto agudo de miocardio (IAM) es la necrosis de las células del miocardio como consecuencia de una isquemia prolongada producida por la reducción súbita de la irrigación sanguínea coronaria, que compromete una o más zonas del miocardio.
El término IAM se debe emplear cuando haya evidencia de daño miocárdico (definido como la elevación de troponinas cardiacas a valores superiores al percentil 99 del límite superior de referencia), con presencia de necrosis en un contexto clínico compatible con isquemia miocárdica.(4)
Para iniciar inmediatamente estrategias de tratamiento, como la reperfusión, normalmente se designa como pacientes con IAMCEST a los que sufren dolor torácico persistente u otros síntomas que indiquen isquemia, y el electrocardiograma (ECG) muestre elevación del segmento ST, en al menos 2 derivaciones contiguas, mientras que, si no hay elevación del segmento ST, se les designa como pacientes con infarto agudo de miocardio sin elevación del segmento ST (IAMSEST), (cuyo manejo se describe en otra guía).(1)
En algunos pacientes con IAM aparecen ondas Q (IAM con onda Q), pero en muchos casos esto no ocurre (IAM sin onda Q).
Aparte de estas categorías, el IAM se clasifica en distintos tipos dependiendo de las características patológicas, clínicas y pronósticas, además de diferencias en las estrategias terapéuticas, como se describe a continuación:(4)
Tipo 1: IAM espontáneo relacionado a isquemia debida a un evento coronario primario (erosión de la placa y/o ruptura, fisura o disección).
Tipo 2: IAM secundario a isquemia debida al desequilibrio entre demanda y aporte de O2 coronario por: espasmo coronario, embolia coronaria, anemia, arritmias, hipertensión e hipotensión.
Tipo 3: muerte súbita inesperada, incluida parada cardiaca, frecuentemente con síntomas sugestivos de isquemia miocárdica, acompañado presumiblemente de nueva elevación del ST, o bloqueo de rama izquierda (BRI) nuevo, o evidencia de trombo fresco en una arteria coronaria por angiografía y/o autopsia, pero que la muerte haya ocurrido antes de la toma de muestras de sangre, o que las muestras hayan sido tomadas antes para que existan biomarcadores en sangre.
Tipo 4: relacionado con procedimiento coronario.
- Tipo 4a: IAM asociado con intervencionismo coronario percutáneo en menos de 48h.
- Tipo 4b: IAM asociado con trombosis de endoprótesis vascular (stent), demostrado por angiografía o autopsia.
- Tipo 4c: IAM asociado a reestenosis del stent o reestenosis después de angioplastia con balón en territorio del infarto.
Tipo 5: IAM asociado a cirugía de derivación aortocoronaria.
A pesar de que la mayoría de los IAMCEST se clasifican como IAM de tipo I (con evidencia de trombos coronarios), algunos IAMCEST entran en otras categorías de infarto. El IAM, incluso cuando se presenta como IAMCEST, también puede ocurrir en ausencia de enfermedad arterial coronaria (EAC) en la coronariografía. Este tipo de IAM se denomina «infarto de miocardio sin enfermedad coronaria obstructiva» (MINOCA).(1)
1.2 Fisiopatología
Los síndromes coronarios agudos (SsCA) son una manifestación de la aterosclerosis que pone en riesgo la vida del paciente y normalmente se precipita por la aparición de una trombosis aguda, inducida por la rotura o la erosión de una placa aterosclerótica, con o sin vasoconstricción concomitante, que produce una reducción súbita y crítica del flujo sanguíneo. La rotura de la placa expone sustancias trombógenas que pueden producir un trombo extenso en la arteria relacionada con el infarto. Una red colateral adecuada que impida la necrosis puede dar lugar a episodios asintomáticos de oclusión coronaria. Los trombos completamente oclusivos producen de forma característica una lesión transparietal de la pared ventricular en el lecho miocárdico irrigado por la arteria coronaria afectada y suelen elevar el segmento ST en el ECG.(5,6,7,8)
En el complejo proceso de rotura de una placa, se ha demostrado que la inflamación es un elemento fisiopatológico clave. En casos esporádicos, los SsCA pueden tener una etiología no aterosclerótica (arteritis, traumatismo, disección, embolia, anomalías congénitas, adicción a la cocaína y las complicaciones del cateterismo cardiaco).(7)
1.3 Epidemiología
En casi todo el mundo la enfermedad coronaria es la causa más frecuente de muerte y su frecuencia está en aumento.(1,8,9) Al menos la mitad de las personas que sufren un IAM fallecen en la primera hora, antes de alcanzar los servicios de emergencia hospitalarios. Mientras que la incidencia del IAMCEST está disminuyendo, la del IAMSEST está en aumento. La incidencia del IAMCEST muestra un patrón constante en afectar con mayor frecuencia a personas más jóvenes que a las de más edad y más a los varones que a las mujeres.(1)
En Cuba durante los años 2018 y 2019 ocurrieron 7387 y 7248 fallecimientos por IAM respectivamente.(10) La provincia Cienfuegos ha disminuido la letalidad intrahospitalaria por IAM.(11)
2. Diagnóstico inicial
La atención al IAMCEST, incluidos el diagnóstico y el tratamiento, comienza con el primer contacto médico (PCM), definido como el momento de la primera evaluación del paciente realizado por un galeno, personal paramédico u otro personal de urgencias, con capacidad para obtener e interpretar el electrocardiograma (ECG) y proporcionar intervenciones iniciales (por ejemplo: la desfibrilación). (1,3,7)
El diagnostico de IAMCEST se define como el momento en que se interpreta el ECG de un paciente con síntomas de isquemia y elevación del segmento ST o equivalente. Este se basa normalmente en la presencia de síntomas (por ejemplo: dolor torácico persistente) y alteraciones del ECG de 12 derivaciones, que indiquen isquemia miocárdica.(1 3,7)
2.1 Síntomas:
Los síntomas se manifiestan con forma dolorosa precordial típica: historia de malestar/dolor centro torácico (área difusa) de 20 minutos o más de duración (son posibles otras localizaciones como la epigástrica o interescapular), que aparece en reposo o en ejercicio, no alivia totalmente con la nitroglicerina, no se modifica con los movimientos musculares, respiratorios ni con la postura. La molestia puede describirse como algo que aprieta, pesa, ahoga, arde, quema, o solo como dolor, de intensidad variable, a menudo ligera (especialmente en ancianos). Rara vez es punzante o muy localizada. Datos importantes son la posibilidad de irradiación a zonas como: el cuello, mandíbula, hombro (s), brazo (s), muñeca (s) o la espalda y la asociación de manifestaciones como disnea, sudoración, frialdad, náuseas y vómitos (estas últimas aisladas o en combinación).(3)
Los pacientes con IAMCEST pueden presentarse con complicaciones como edema pulmonar agudo, choque, síncope, arritmias diversas o accidente vascular encefálico. Entre el 30 y el 60 % hay pródromos días o semanas antes (angina nueva).(1,3,6)
Las directrices del American College of Cardiology (ACC) y del American Heart Association (AHA) enumeran los siguientes síntomas que describen el dolor y no son características de isquemia miocárdica:(12)
• Dolor pleurítico (es decir, un dolor agudo o cortante provocado por los movimientos respiratorios o la tos).
• Localización primaria o única de las molestias en la región abdominal central o inferior.
• El dolor que puede localizarse a punta de dedo, en particular sobre el vértice del ventrículo izquierdo.
• El dolor reproducido con el movimiento de palpación de la pared torácica o de los brazos.
• El dolor constante que persiste muchas horas.
• Los episodios muy breves de dolor que duran unos segundos o menos.
• El dolor que se irradia a extremidades inferiores.
2.2 Electrocardiograma:
En un contexto clínico apropiado, la elevación del segmento ST (medida en el punto J) puede indicar IAMCEST en los siguientes casos:
- ≥ 1 mm en al menos 2 derivaciones contiguas (en ausencia de hipertrofia del ventrículo izquierdo [VI], bloqueo de la rama izquierda [BRI] o síndrome de WPW). En las derivaciones V2-V3 se exige una elevación del segmento ST ≥ 2,5 mm en los varones menores de 40 años, ≥ 2 mm en los de 40 o más o ≥ 1,5 mm en las mujeres independientemente de la edad.
- En pacientes con IAM inferior, se recomienda registrar las derivaciones precordiales derechas (V3R y V4R) en busca de la elevación del segmento ST e identificar el infarto del ventrículo derecho (VD) concomitante.
- Asimismo, la depresión del segmento ST en las derivaciones V1-V3 indica isquemia miocárdica, especialmente cuando la onda T terminal es positiva (equivalente a la elevación del segmento ST), y la confirmación de una elevación del segmento ST ≥ 0,5 mm registrada en las derivaciones V7-V9 se considera un medio para identificar el IAM posterior.
Otros aspectos de importancia a tener en cuenta a la hora de interpretar el ECG:
- La presencia de ondas Q en el ECG no debe influir necesariamente en las decisiones sobre la estrategia de reperfusión.(1)
- A los pacientes con sospecha clínica de isquemia miocárdica y bloqueo de rama izquierda (BRI), se los debe tratar de modo similar que a los pacientes con IAMCEST, independientemente de que el BRI ya fuera conocido. Hay que señalar que la presencia (o la sospecha) de nuevo BRI no predice el IAM per se. En presencia de BRI antiguo en paciente con síndrome coronario agudo (SCA), los siguientes criterios añaden valor diagnóstico:(1) [elevación concordante de ST ≥ 1mm en derivaciones con complejo QRS positivo (DI, aVL, V5 y V6); depresión concordante de ST ≥ 1mm en V1-V3; elevación discordante de ST ≥ 5mm en derivaciones con complejo QRS negativo (V1-V3)].
- Algunos pacientes con oclusión coronaria aguda pueden tener un ECG inicial sin elevación del segmento ST, a veces debido a que se les explora muy precozmente tras el inicio de los síntomas (en estos casos hay que buscar ondas T hiperagudas, que pueden preceder a la elevación del segmento ST). Es importante repetir el ECG o monitorear el segmento ST. Además, preocupa que algunos pacientes con oclusión aguda de una arteria coronaria e IAM en curso (como aquellos con arteria circunfleja (Cx) ocluida, oclusión aguda de injerto venoso o enfermedad de tronco) puedan presentarse sin elevación del segmento ST y se les niegue la terapia de reperfusión, lo que acaba por producir infartos más extensos y peores resultados clínicos. Extender el ECG estándar de 12 derivaciones con derivaciones V7-V9 puede ayudar a la identificación de algunos de estos pacientes.(1)
- El IAM de la porción inferobasal del corazón, que a menudo corresponde al territorio de la arteria Cx, donde el principal hallazgo es la depresión aislada del segmento ST ≥ 0,05 mm en las derivaciones V1-V3, debe tratarse como un IAMCEST. Se recomienda el uso de derivaciones torácicas posteriores adicionales (elevación V7-V9 ≥ 0,05 mm [≥ 0,1 mm en los varones mayores de 40 años]) para detectar elevaciones del segmento ST compatibles con IAM inferobasal.(1)
- La presencia de una depresión del segmento ST ≥ 1 mm en 8 o más derivaciones de superficie (depresión inferolateral del segmento ST), unida a la elevación del segmento ST en aVR o V1, indica isquemia multivaso u obstrucción del tronco común, especialmente si el paciente sufre deterioro hemodinámico.(1)
2.3 Biomarcadores:
La determinación de marcadores séricos mediante análisis de sangre es sistemática en la fase aguda, pero, aunque está indicada, no debe retrasar el tratamiento de reperfusión.(1,4)
Como resultado de la necrosis miocárdica aparecen en sangre las proteínas: mioglobina, troponinas T e I, creatina fosfoquinasa (CPK) y lactato deshidrogenasa (LDH). Se realiza el diagnóstico de IAM cuando se elevan en sangre los marcadores más sensibles y específicos de necrosis: troponinas cardíacas y la fracción MB de la CPK (CPK-MB), que reflejan el daño en el miocardio, pero no indican su mecanismo de aparición, de tal manera que un valor elevado sin evidencia clínica de isquemia obliga a buscar otras causas de lesión.(3,4)
- CPK-MB: se eleva a las 4-8 horas tras el IAM y se normaliza entre 2 y 3 días después, su elevación sostenida debe hacer pensar en origen no cardíaco.
- Troponinas T e I: la troponina en sangre es un indicador muy sensible y específico de necrosis celular miocárdica. La determinación recomendable es la cuantitativa, aunque pueden usarse métodos cualitativos que son menos sensibles y determinados. Aparecen en sangre apenas unas pocas horas del inicio (3h), alcanzando concentraciones máximas a las 12-48 horas y permanecen elevadas 7-10 días. Se debe solicitar en el momento del ingreso en urgencias, si el resultado es negativo y existe un índice de sospecha alto se repetirá a las 6 y a las 12 horas. Para establecer el diagnóstico se valorará la determinación de troponina a las 12 horas desde el inicio de los síntomas. El valor de referencia normal de troponina es cero. Puede estar ligeramente elevada en pacientes con embolismo pulmonar, falla cardiaca, miocarditis, insuficiencia renal, sepsis, cirrosis y artritis reumatoide. Su elevación en ausencia de cuadro clínico sugerente no supone la existencia de IAM. Un resultado negativo de los marcadores enzimáticos realizado a las 12 horas de los síntomas, excluye el infarto de miocardio. Para sustentar el diagnóstico de necrosis miocárdica se realizan determinaciones seriadas cada 8 y 12 horas y se requiere que muestren la curva de ascenso y su normalización típica para cada una de las enzimas.(3)
Clásicamente y de acuerdo con la Organización Mundial de la Salud (OMS) el diagnóstico de IAM está basado en la presencia de al menos dos de los tres criterios (clínicos, electrocardiográficos y enzimáticos).(3)
Sociedades cardiológicas internacionales por medio de conferencias y publicaciones han re-examinado la definición de IAM a partir de 1999. Esta redefinición de los criterios de IAM, basados en la presencia de troponina en sangre, ha contribuido a que aumente el número de casos de necrosis miocárdica diagnosticadas, con las consiguientes repercusiones sobre el individuo, la sociedad y los servicios de salud. En 2018 ha sido publicada la cuarta redefinición.(4)
En nuestro medio no contamos con biomarcadores, específicamente troponina, ni se llevan a cabo procedimientos de ICP ni RMQuir, por lo que el diagnóstico de IAM está basado en los criterios clásicos de la OMS, incluyendo los hallazgos de anatomía patológica.(3)
3. Manejo inicial (en servicios de urgencias, hospitalarios o extrahospitalarios) y tratamiento intrahospitalario
3.1 Manejo inicial (primer contacto médico y flujo en el Servicio de Urgencias).(1,3,8)
Se realizará historia clínica, exámen físico y ECG (obtenido e interpretado en un tiempo no superior a 10 minutos) a todos los pacientes con dolor torácico en los que se sospeche el diagnóstico de un IAMCEST. El diagnóstico temprano y el traslado urgente son claves para la supervivencia. La terapia temprana mejora de manera decisiva el pronóstico. Una vez sospechado el diagnóstico debe tratarse como un código rojo e iniciar tratamiento inmediatamente.
a. Reposo horizontal con monitorización eléctrica continua, se realiza colocando un monitor desfibrilador cerca del paciente, con acceso intravenoso periférico y monitorización no invasiva de la saturación de oxígeno.
b. Alivio del dolor: opiáceos (IIa C)
Morfina de elección (ámpula de 10-20 mg) usar de 4-8 mg intravenoso (IV) (dosis repetibles de 2 mg cada 5-15 minutos)
En el orden práctico se debe diluir un ámpula de cloruro mórfico de 10 mg (I cc) en 9 cc de suero fisiológico y se obtendrá una solución de 1mg de morfina por cada cc.
Si se aprecia efecto vagotónico es importante tras la administración de morfina (bradicardia, hipotensión), administrar atropina (ámpulas de 0,5 mg) 0,5-1 mg IV hasta una dosis de 2 mg si necesario, junto a posición de trendelemburg y volumen).
Si se conoce hipersensibilidad conocida a la morfina o si el IAM inferior se expresa con gran descarga vagal, hipotensión o bradiarritmia, se prefiere la meperidina (ámpula de 50-100 mg) 25 mg IV (dosis repetible cada 5-15 minutos).
Si se presentan vómitos importantes se deben usar antieméticos (metoclopramida 5-10 mg IV que puede administrarse al mismo tiempo que los opiáceos).
Evitar inyecciones intramusculares.
c. Oxígeno: 2-4 litros por catéter nasal o máscara. Está indicada la administración de oxígeno a pacientes con hipoxemia (SaO2< 90 % o PaO2< 60 mmHg) (I C). No se recomienda la administración sistemática de oxígeno cuando la SaO2 sea ≥ 90 % (III B).
d. Nitritos: se debe administrar nitroglicerina (NTG): 1 tableta (0,5 mg) sublingual (SL) de entrada que se puede repetir cada 5 minutos por 3-4 dosis. (IIb A)
No se debe utilizar si hay prensión arterial sistólica (PAS) menor de 90 mmHg o frecuencia cardiaca (FC) menor de 50 o mayor de 100 latidos por minuto (lpm) y sospecha de IAM de ventrículo derecho (VD).
e. Antiplaquetarios:
Aspirina (AAS): (I B) dosis de 150-300 mg masticada y tragada tan pronto se inicien los síntomas. Se prefiere sin cubierta entérica y una dosis promedio inicial de 250 mg. No se debe usar si se conoce alergia conocida a los salicilatos.
Clopidogrel: (IA) (tabletas de 75 mg) dosis de carga si el paciente recibirá tratamiento trombolítico con estreptoquinasa recombinante (SKR): 300 mg en pacientes menores de 75 años y 75 mg en mayores. Si no indicación de SKR dosis de 75 mg para cualquier edad.
f. Restauración del flujo coronario y reperfusión del tejido miocárdico.
El tratamiento de reperfusión está indicado para todo paciente con síntomas de isquemia de duración ≤ 12 horas y elevación persistente del segmento ST (IA).
Si la ICP primaria no se puede realizar en el momento adecuado tras el diagnóstico de IAMCEST, se recomienda el tratamiento fibrinolítico en las primeras 12 horas de la presentación de los síntomas en pacientes sin contraindicaciones (IA).
Cuando la fibrinolisis sea la estrategia de reperfusión, se recomienda iniciar este tratamiento lo antes posible tras el diagnóstico de IAMCEST, preferiblemente en el contexto prehospitalario (IA).
La trombolisis prehospitalaria es efectiva y puede practicarse con seguridad en las Áreas Intensivas Municipales, sobre todo: si el tiempo previsto para el arribo al hospital es superior a los 30 minutos, menos de dos horas de iniciados los síntomas y ausencia clara de contraindicaciones.
- Tratamiento fibrinolítico con SKR: debe administrase idealmente antes de los 30 minutos y nunca más de 60 minutos tras el arribo o primer contacto médico. Recientemente se ha propuesto que cuando la estrategia de reperfusión es la fibrinólisis la demora debe reducirse a 10 minutos.
Criterios para su uso:
Dolor torácico isquémico de 30 minutos o más de duración (o síndrome equivalente sospechoso de IAM), (Ver acápite 2.1) iniciados dentro de las 12 horas previas con:
- Supradesnivel del ST mayor de 1mm en dos o más derivaciones contiguas. (Ver acápite 2.2).
- BRI nuevo o presumiblemente nuevo. (Ver acápite 2.2).
Contraindicaciones:
Absolutas:
- Accidente cerebrovascular hemorrágico o de origen desconocido previos, en cualquier momento.
- Accidente cerebrovascular isquémico en los últimos 3 meses.
- Traumatismo o neoplasia conocidos del sistema nervioso central.
- Sospecha de disección aórtica.
- Alteración hemorrágica conocida o sangrado activo (se exceptúa la menstruación).
- Sangrado gastrointestinal en el último mes.
- Traumatismo, cirugía o daño encefálico reciente importante en las últimas 3 semanas.
- Punciones vasculares no compresibles en las últimas 24 h (por ejemplo: biopsia hepática y punción lumbar).
Relativas:
- Historia de accidente cerebrovascular isquémico de más de tres meses.
- Hipertensión refractaria (PAS > 180 mmHg y/o presión diastólica > 110 mmHg).
- Resucitación traumática o prolongada.
- Exposición previa (entre 5 días y 6 meses) a SKR o reacción alérgica previa.
- Embarazo y primera semana de puerperio.
- Úlcera péptica activa.
- Endocarditis infecciosa
- Tratamiento anticoagulante oral a dosis terapéuticas.
- Hepatopatía avanzada.
Esquema de tratamiento.
SKR (Heberquinasa): 1 500 000 Uds. en 100 ml de solución salina fisiológica 0,9 % o dextrosa 5 %, a pasar en 30-60 minutos por una vena periférica, preferiblemente en bomba de infusión.
Modo de preparación: instilar el agua disolvente (5 cc) lentamente por las paredes del bulbo y rotar suavemente hasta disolver, introducir el medicamento disuelto en el frasco de infusión lentamente. Todo ello evita la formación de burbujas.
Monitoreo durante la infusión: tomar tensión arterial (TA) cada 5 minutos y mantener vigilancia eléctrica.
Manejo de efectos adversos:
- Hipotensión: elevar miembros inferiores, disminuir velocidad de infusión, volumen, suspender infusión, atropina, dopamina.
- Sangrado: según cuantía, compresión de sitios de punción, volumen, glóbulos, uso de Epsilon Amino Caproico (EACA).
- Alergia – Anafilaxia: antihistamínicos, esteroides (nunca profilácticos).
El traslado del paciente a la Unidad de Cuidados Intensivos Coronarios (UCIC) se realizará con un médico entrenado, manteniendo la monitorización electrocardiográfica siempre que sea posible, que incluye la disponibilidad de un desfibrilador y previo consentimiento del médico a cargo de dicha unidad.
En los IAM complicados con necesidad de ventilación se trasladarán bajo las mismas condiciones a la unidad de cuidados intensivos polivalentes.
3.2 Tratamiento en la UCICOR.(1,3,8)
3.2.1 Medidas generales, exámenes complementarios e intervención psicológica precoz:
- Monitorización electrocardiográfica continua durante 48-72 horas (más allá si existen complicaciones).
- Oximetría de pulso: en las primeras 6 horas (más allá si existe congestión pulmonar o inestabilidad hemodinámica).
- Signos vitales cada 1 hora (primeras 6 horas); cada 2 horas (resto de las primeras 24 horas) y luego cada 3-4 horas, en casos no complicados. En la sección de camas convencionales se indicarán por cada turno.
- Medir diuresis cada 3 horas en las primeras 24 horas y luego cada turno en casos no complicados.
- Alivio máximo del dolor y la ansiedad: narcóticos, educación, apoyo psicológico y ansiolíticos (en pacientes ansiosos (IIa C), no de rutina: diazepam 5 mg c/12 horas o alprazolam 0,5 mg c/12 horas)
- Oxigenoterapia por catéter nasal o máscara a 2-4 litros por minutos si falta de aire, hipoxia o signos de insuficiencia cardiaca.
- Nivel de actividad: reposo absoluto en cama al menos 12 horas. Más allá si existe inestabilidad hemodinámica. Evitar “la discontinuidad fisiológica”, permitiendo un bajo nivel de actividad y movilización temprana (ver rehabilitación). Prohibida la maniobra de Valsalva (uso de laxantes).
- Dieta: no se deber ingerir ningún alimento por vía oral durante 6 horas y hasta que el paciente esté libre de dolor, luego se incorpora dieta líquida según la tolerancia del paciente en las primeras 24 horas. Progresar hacia una dieta saludable al corazón (segundo día, dieta blanda y líquida y tercer día dieta libre hipocalórica), ofrecer alimentos ricos en potasio, magnesio, fibra y ácidos grasos omega 3.
- Permanencia en la sección de Cuidados Intensivos: 48 horas en pacientes de bajo riesgo no complicados, previa constatación de buena tolerancia a la movilización inicial, 24-48 horas en la sección de cuidados intermedios.
- Complementarios:
- Generales al ingreso (hemograma, glicemia, ionograma, coagulograma, lípidos y perfil hepático, que se repetirán según las características del paciente o las complicaciones).
- Rayos X (Rx) de tórax (al ingreso y repetir si hay complicaciones o después de cateterismo venoso profundo),
- ECG (a los 90 minutos del inicio del tratamiento trombolítico y luego c/24 horas, frecuencia mayor si hay sospecha de complicaciones),
- Biomarcadores séricos (CPK total y CK-MB) c/8 horas en las primeras 24 horas y c/24 horas hasta 48-72 horas,
- Ecocardiografía (precoz para la toma de decisiones si el resultado del ECG no evidencia diagnóstico, de inmediato si se sospecha de complicación mecánica y a todos los pacientes en algún momento de la hospitalización y ante la sospecha de enfermedad cardiaca asociada.
Orientación e intervención psicológica precoz.
Los pacientes que han sufrido un IAM se benefician de una evaluación psicológica precoz.(13) Esta forma parte del programa de rehabilitación y debe ser un proceso continuo. El protocolo está dirigido al control elemental de las emociones, la adecuación del enfrentamiento a la enfermedad y al inicio de la prevención secundaria.
3.2.2 Tratamiento antitrombótico.
Antiplaquetarios:
AAS: (I B) 150-300 mg/día masticada y tragada lo antes posible el primer día, independiente del uso o no de trombolíticos (debe ser administrada en el primer contacto médico) y continuada indefinidamente (75-100 mg/ día). Está contraindicada si existe alergia conocida a los salicilatos y debe prescribirse con precaución si discrasias sanguíneas o hepatopatías severas.
Clopidogrel: (I A) 75 mg /día. (Dosis de carga si SKR según edad ya descrita). Independiente del uso o no de trombolíticos. Durante un año.
La doble terapia antiplaqueta (DTAP) está indicado hasta 1 año para pacientes tratados con fibrinólisis (I C).
Anticoagulantes
Heparina:
Con tratamiento de reperfusión (trombolisis):
- Heparina de bajo peso molecular (HBPM): enoxaparina (Clexane) (IA) (de elección): Dosis s.c. de 1 mg/kg administrados cada 12 h hasta el alta durante un máximo de 8 días.
Las primeras dos dosis s.c. no deben exceder los 100 mg
En pacientes con tasa de filtrado glomerular (TFG) < 30 ml/min (enfermedad renal avanzada), independientemente de la edad, la dosis s.c. se administra cada 24 h.
En pacientes ≥75 años dosis s.c. de 0.75mg/Kg/12h (no exceder de 75 mg las primeras dos dosis.
- HBPM: nadroparina (fraxiparina): dosis de 84 UI/ Kg, administrada cada 12 horas hasta el alta durante un máximo de 8 días, de forma práctica 0,4, 0,5, 0,6 y 0,7 ml (SC) en pacientes de 40, 50, 60 y 70 Kg de peso respectivamente. (IIa B). Contraindicada si TFG < 30ml/min.
- Heparina no fraccionada (HNF) (I B): en caso de no contar con las heparinas de bajo peso molecular o estar contraindicadas.
La administración de heparina IV debe ser monitorizada rigurosamente; las determinaciones de TTPA > 70 se asocian a un mayor riesgo de muerte, sangrado y reinfarto, se precisan valores de TTPA entre 1.5-2.5 veces el control.
Pauta de tratamiento: HNF IV. Se recomiendan dosis de 1cc cada 4 horas por vía iv con seguimiento del TTPA según disponibilidad.
Contraindicaciones de la heparina:
a. Absolutas: aneurisma intracraneal, disección aórtica, hemorragia cerebral, hemorragia activa intratable, hipertensión arterial (HTA) severa no controlada.
b. Relativas: discrasias sanguíneas (hemofilia, plaquetopenia), endocarditis infecciosa, úlcera gastroduodenal, neurocirugía reciente o cercana, pericarditis o derrame pericárdico, alteración hepática o renal, trauma severo, ingestión de salicilatos u otros anticoagulantes, radioterapia u otras lesiones hemorrágicas.
Sin tratamiento de reperfusión:
Los pacientes que se presentan durante las primeras 12 h de la aparición de los síntomas y no han recibido tratamiento de reperfusión o los pacientes que se presentan más de 12 h después, deben ser tratados lo antes posible con aspirina, clopidogrel y tratamiento antitrombinico (enoxaparina, fraxiheparina, HNF), a las mismas dosis que lo expuesto para el tratamiento conjunto con el tratamiento fibrinolítico.
Recomendaciones:
- Administrar dosis s.c.de HBPM hasta el alta del paciente (I B), de elección.
- HNF IV cada 4 horas si no se cuenta con las de bajo peso molecular.
3.2.3 Tratamientos sistemáticos de fase aguda, subaguda y a largo plazo tras un IAMCEST.
- Bloqueadores beta (BB):
Debe considerarse tratar sistemáticamente con BB orales durante el ingreso y después del alta a todo paciente que no tenga contraindicaciones (IIa B).
Atenolol: dosis inicial por vía oral de acuerdo a la situación clínica: 25-50 mg vía oral cada 24 horas.
Está indicado el tratamiento oral con BBA para pacientes con insuficiencia cardiaca o fracción de eyección del VI (FEVI) ≤ 40 %, siempre que no haya contraindicaciones (I A).
Carvedilol (6,25 y 12,5 mg) dosis de inicio 3,125 mg c/12 horas y aumentar si necesario.
Contraindicaciones: disfunción ventricular grave (Killip III, IV), FC menor de 60 por minuto, bloqueo auriculoventricular (BAV) de grado mayor al primero, antecedentes de broncoespasmo.
BB IV: atenolol dosis inicial 5 mg IV seguida de la dosis oral a la hora, en determinadas situaciones clínicas (HTA, taquiarritmias, no tolerancia de la vía oral).
- Inhibidores de la enzima convertidora de angiotensina I (IECA):
Debe considerarse administrar IECA a todos los pacientes siempre que no haya contraindicaciones (IIa A).
Se recomienda administrar IECA, comenzando en las primeras 24 horas tras el IAMCEST, a los pacientes con evidencia de insuficiencia cardiaca, disfunción sistólica del VI, diabetes o infarto anterior (I A).
Pauta de tratamiento: vía oral. Captopril (25mg) administrado cada 8 horas.
Comenzar con dosis bajas (6,25 mg) e ir aumentando hasta dosis plena en 24-48 horas 25mg cada 8 h; enalapril (20mg) cada 12 horas, comenzar con 5-10 mg y se puede aumentar hasta 40mg diarios si el paciente es hipertenso (según necesidades). Duración del tratamiento: continuados a largo plazo.
Contraindicaciones:
PAS menor de 100 mmHg.
Insuficiencia renal clínicamente relevante.
Estenosis bilateral de la arteria renal.
Alergia conocida a los IECA.
- Hipolipemiantes orales:
Se recomienda comenzar con atorvastatina tan pronto sea posible, si no hay contraindicaciones, y mantenerla a largo plazo (I A).
Se recomienda un objetivo de (colesterol LDL) cLDL < 1,8 mmol/l (70 mg/dl) o una reducción ≥ 50 % si la determinación basal de cLDL es de 1,8-3,5 mmol/l (70-135 mg/dl) (I B).(14)
Atorvastatina: 20 mg a las 9.00 pm
Debe mantenerse el tratamiento a largo plazo, independientemente del perfil lipídico.
En los casos de alto riesgo puede indicarse tratamiento intensivo con estatinas (dosis mayores toleradas 40-80 mg)
- Antagonistas del receptor de mineralocorticoide (espironolactona). Recomendada para pacientes con fracción de eyección del ventrículo izquierdo (FEVI) ≤ 40 % e insuficiencia cardiaca o diabetes tratados con un IECA y un BBA, siempre que no haya insuficiencia renal o hiperpotasemia (I B). Espironolactona 25 mg diarios.
- Nitratos: los nitratos orales no tienen indicación rutinaria en los infartos no complicados.
- Magnesio. nunca como rutina. Corrección de la hipomagnesemia documentada especialmente si se ha impuesto tratamiento diurético previo y en el episodio de Torsión de Puntas asociada a QT largo (bolos de 1-2 g en 5 minutos).
- Anticálcicos (III B). Nunca de rutina: Verapamilo o diltiazem para el dolor isquémico persistente y para disminuir la respuesta ventricular a la fibrilación auricular, pero solo cuando los bloqueadores beta adrenérgicos son inefectivos o estén contraindicados y no exista contraindicación [disfunción del ventrículo izquierdo (VI)], BAV).
4. Tratamiento del IAM complicado.(1,3,8,15,16)
4.1 Pericarditis
La pericarditis aguda puede complicar el IAMCEST. El dolor producido por la pericarditis se distingue porque es muy agudo y está relacionado con la postura y la respiración. El diagnóstico puede confirmarse con la auscultación de un roce pericárdico y por ecocardiograma.
Se presenta en el 14 % cuando se exige roce pericárdico. Ha disminuido su incidencia en la era de la trombolisis.
Tratamiento: aspirina: pueden necesitarse hasta 1000 mg/24h cada 4-6 horas. Debe interrumpirse el tratamiento antitrombínico, excepto cuando haya una indicación absoluta de continuación de tratamiento.
Deben evitarse analgésicos y antiinflamatorios (AINE) y esteroides, excepto en el síndrome de Dressler.
4.2 Angina posinfarto:
Considerado así, el dolor isquémico presentado desde las 24 horas del IMA hasta los 30 días posteriores.
Tratamiento: BBA, NTG-IV, Anticálcicos del tipo no dihidropiridínicos, anticoagulación, IECA. Candidatos a ICP.
4.3 Reinfarto: 10 % en general, pero solo 3-4 % si se practica trombolisis más aspirina. Diagnóstico: dolor isquémico mayor de 30 minutos, nueva elevación del ST mayor o igual de 1 mm en 2 derivaciones contiguas (no siempre), nueva elevación de CK-MB (mayor del valor normal o 50 % o más del valor previo).
Tratamiento: no se recomienda retrombolisis, candidatos a angiografía e ICP.
4.4 Complicaciones mecánicas.
La terapia de reperfusión temprana ha disminuido sustancialmente su incidencia. Informes recientes reportan estimaciones de su ocurrencia entre 0,27 y 0,91 % tras un IAMCEST [Rotura de pared libre (0,01-0,52 %), Rotura de tabique interventricular (0,17-0,21 %) y Rotura de musculo papilar (0,05-0,26 %)].(15)
4.4.1 Rotura cardiaca de pared libre: se puede presentar de dos formas:
- Rotura aguda de la pared libre.
- Rotura subaguda de la pared libre con formación de pseudoaneurisma.
Diagnóstico: dolor recurrente (puede ser su heraldo), cambios de ST-T, colapso hemodinámico, disociación electromecánica, ecocardiografía. Factores de riesgo: localización anterior, ancianidad, sexo femenino, HTA, esteroides, AINE, IAM transmural, hipertrofia del VI. Prevención: reperfusión temprana. Tratamiento: pericardiocentesis, cirugía de urgencia. Si se aprecia pseudoaneurisma se debe realizar cirugía de urgencia.
4.4.2 Rotura de tabique interventricular:
Diagnóstico: soplo sistólico nuevo, deterioro hemodinámico progresivo, ecocardiografía, cateterismo derecho (salto oximétrico en el ventrículo derecho). La ecocardiografía lo confirma. Factores de riesgo: sexo femenino, ancianidad, enfermedad renal crónica, ausencia de HTA, diabetes, tabaquismo e infarto de miocardio (IM) previo.
Tratamiento: manejo del shock [tratamiento farmacológico: vasodilatadores, diuréticos, inotropos, balón de contrapulsión intraaórtico (BCPAo); opción de ICP; cirugía de urgencia].
4.4.3 Insuficiencia mitral aguda (InMA):
Puede ser causada por disfunción de músculo papilar, rotura de cuerda tendinosa o rotura del músculo papilar (causante esta última de más de la mitad de los casos de InMA severa tras un IM).(15)
Diagnóstico: soplo sistólico nuevo, edema pulmonar intratable dependiendo del tipo, ecocardiografía, cateterismo.
Tratamiento: manejo del edema pulmonar, angiocardiografía y reparación quirúrgica dependiendo del tipo.
4.5 Insuficiencia cardíaca:
Clasificación de Killip Kimball (KK).
- KK I: normal, no hay evidencia de insuficiencia cardiaca.
- KK II: crepitante bibasales o presencia de tercer ruido (galope ventricular izquierdo) o presencia de signos de congestión pulmonar intersticial en el RX de tórax.
- KK III: presencia de edema agudo de pulmón.
- KK IV: shock cardiogénico.
Shock cardiogénico: se considerará cuando exista cuadro clínico de hipoperfusión tisular en pacientes con hipotensión arterial por debajo de 90 mmHg la tensión sistólica por más de 30 minutos o cuando se necesita usar drogas vasopresoras para mantener la tensión arterial sistólica por encima o igual a 90mmHg asociado a presencia de congestión pulmonar, signos de incremento de la presión de llenado ventricular, presencia de alteraciones por la hipoperfusión a otros órganos como: alteraciones del estado mental del paciente, oliguria-anuria, frialdad, sudoración, presencia de gradiente térmico y cianosis distal. En los lugares donde sea posible el monitoreo hemodinámico invasivo de los pacientes estará en relación con disminución del gasto cardiaco por debajo de 2,2 lts/min/m2 y elevación de la presión de enclavamiento pulmonar por encima de 18 mmHg.
Tratamiento:
Es preciso monitorizar continuamente el ritmo cardiaco, la presión arterial y la diuresis de los pacientes con insuficiencia cardiaca. Se debe determinar de forma precoz el mecanismo de la insuficiencia cardiaca mediante exploración física, ECG, ecocardiografía y monitorización hemodinámica invasiva (si no se controla rápidamente), además debe ser corregido cuanto antes.
Los pacientes con congestión pulmonar y SaO2< 90 % o presión parcial de oxígeno (PaO2) < 60 mmHg (8,0 kPa) requieren tratamiento con oxígeno y la monitorización de la SaO2 para corregir la hipoxemia, con un objetivo del 95 % y podrían requerir la evaluación periódica de gases en sangre. El tratamiento inicial incluye la administración i.v. de diuréticos del asa (por ejemplo: 20-40 mg de furosemida i.v. con dosis repetidas a ciertos intervalos dependiendo de la evolución clínica y la diuresis) y, si la presión arterial lo permite, nitratos i.v. evitando la hipotensión o las caídas excesivas de la presión arterial. El uso precoz de BBA y IECA está recomendado siempre que no haya hipotensión, hipovolemia o disfunción renal. El tratamiento de la causa subyacente es esencial.
Las alteraciones del ritmo, la disfunción valvular y la hipertensión deben corregirse lo antes posible. La hipertensión debe tratarse rápidamente con IECA orales y nitratos i.v. En los casos críticos, podría ser necesaria una infusión de nitroprusiato de sodio (NTPNa). La isquemia miocárdica persistente requiere tratamiento precoz con revascularización coronaria. Las arritmias auriculares y ventriculares, así como la disfunción valvular o las complicaciones mecánicas, deben tratarse.
Los pacientes con síntomas graves y congestión pulmonar pueden necesitar morfina i.v. para reducir la disnea y la ansiedad, pero, por cuestiones de seguridad, no se recomienda el uso sistemático, porque puede producir náuseas e hipopnea.
La ventilación con presión positiva no invasiva (presión positiva continua o presión positiva bifásica en las vías aéreas) o el tratamiento con alto flujo a través de cánulas nasales son efectivos para tratar el edema pulmonar y se debe considerar e iniciar pronto para los pacientes con dificultad respiratoria (tasa respiratoria > 25 respiraciones/min, SaO2< 90 %). La intubación endotraqueal y el apoyo ventilatorio podrían ser necesarios para pacientes que no alcanzan una oxigenación adecuada.
Se puede considerar la ultrafiltración para reducir la carga de fluidos en pacientes refractarios al tratamiento diurético, especialmente aquellos con hiponatremia.
Resumen del tratamiento de la disfunción del VI según la clasificación de KK.
- Congestión pulmonar ligera (Killip II): diuréticos, nitratos, IECA, corrección de la hipoxemia, presión positiva continua en la vía respiratoria.
- Congestión pulmonar severa (Killip III): diuréticos intravenosos, NTG-IV, morfina, corrección de la hipoxemia (oxigenoterapia, ventilación mecánica), monitoreo invasivo si es refractario.
- Shock cardiogénico: oxígeno, apoyo ventilatorio mecánico según gasometría, diuresis horaria, corrección de la hipoxemia y desequilibrio ácido básico, apoyo inotrópico (dobutamina, dopamina), BCPA o revascularización temprana (ICP, cirugía de derivación), reparación de complicaciones mecánicas. (Tabla 1).
4.6 Infarto agudo del miocardio de ventrículo derecho:
Con manifestaciones clínicas en 10-15 % de todos los pacientes con IM inferior.
Diagnóstico:
Hipotensión, pulmones claros, aumento de la presión venosa yugular (sensibilidad del 25 %), distensión de las venas del cuello, signo de Kussmaul, ECG (elevación de ST mayor o igual de 1 mm en V4R, las ondas Q y la elevación del segmento ST en V1-3 también señalan a un infarto del ventrículo derecho), ecocardiografía (VD mayor de 25 mm, anomalías de contractilidad segmentaria, cortocircuito de derecha a izquierda auricular).
Tratamiento:
Mantener precarga óptima para VD: volumen (solución salina fisiológica), evitar nitratos y diuréticos, mantener sincronismo aurículo ventricular (AV), marcapasos (MP) secuencial si bloqueo AV sin respuesta a la atropina), cardioversión rápida si taquiarritmia supraventricular (frecuente la fibrilación auricular) con repercusión, si no mejora el gasto con volumen. Disminución de la postcarga de VD si existe disfunción concomitante del VI: BCPAo, IECA.
Reperfusión: farmacológica o no.
Agentes inotrópos no digitálicos:
• Dopamina: ámpula 200 mg. Dosis: 2 hasta 20mcg/ kg/min. Se usa si hipoperfusión con TA menor de 90 mmHg o disminución de 30 o más mmHg por debajo del valor basal (5-10 mcg/kg/minuto).
• Dobutamina: bulbo 250 mg. Dosis: 2-20 mcg/kg/min. Se indica si hay shock o hipoperfusión importante con congestión pulmonar asociada.
• Norepinefrina: ámpula 4mg. Dosis: 0,1-0,12 mcg/ kg/min. Si hipotensión extrema a pesar de dopamina a 20 o más mcg/Kg/minuto.
4.7 Hipertensión arterial:
La HTA inicial ligera debe normalizarse tras tratamiento habitual (alivio máximo del dolor, BBA, nitroglicerina sublingual (NTG-SL), IECA.
Si TA diastólica >110 mmHg la NTG-IV en infusión es de elección.
En casos de resistencia al tratamiento se debe usar NTP Na (0,5-8 mcg/Kg/min) con línea arterial.
4.8 Complicaciones eléctricas:
El tratamiento precoz de reperfusión reduce el riesgo de arritmias ventriculares y muerte cardiovascular. Es escasa la evidencia sobre los beneficios de los fármacos antiarrítmicos en pacientes con IAMCEST y se han demostrado efectos negativos en la mortalidad temprana. Se recomienda un uso cauteloso del tratamiento antiarrítmico y se deben considerar otras opciones de tratamiento, como la cardioversión eléctrica, una estrategia de «esperar y ver» para arritmias sin relevancia hemodinámica o con relevancia moderada, y en algunos casos, el implante de un marcapasos cardiaco. Se recomienda corregir los desequilibrios electrolíticos y el tratamiento precoz con BBA, IECA y estatinas.
4.8.1 Fibrilación auricular (FA): afecta hasta al 21 % de los pacientes con IAMCEST. Los pacientes con IAMCEST y FA documentada tienen peor pronóstico a corto y largo plazo que los pacientes en ritmo sinusal. Hay que señalar que la FA transitoria que se resuelve sola durante el IAMCEST se relaciona con una tasa significativamente mayor de accidente cerebrovascular (ACV) durante el seguimiento a largo plazo. Varios estudios, pero no todos, indican que la FA de nueva aparición se puede reducir con BBA, IECA y con tratamiento precoz con estatinas.
Tratamiento:
En muchos casos, la arritmia se tolera bien y no precisa un tratamiento específico, más allá de la anticoagulación. En los casos de inestabilidad hemodinámica aguda, se requiere tratamiento inmediato. En esta situación no está claramente establecido si es más aconsejable el control de la frecuencia o el control del ritmo. Debe considerarse la cardioversión eléctrica, aunque la recurrencia temprana de la FA es frecuente tras el éxito de la cardioversión. El control agudo del ritmo con fármacos antiarrítmicos está limitado al uso de amiodarona. (Tabla 2).
Dosis de fármacos (Ver Tabla 1).
4.8.2 Taquicardia ventricular (TV):
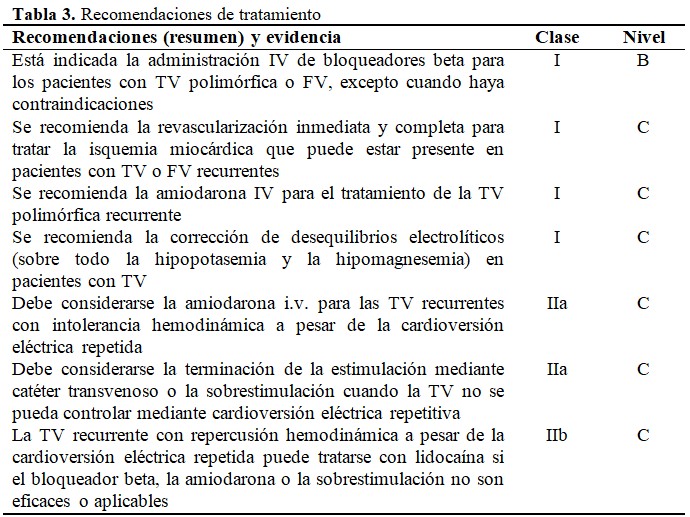
La incidencia de la TV y la fibrilación ventricular (FV) ha disminuido en las últimas décadas, probablemente debido a la incorporación de estrategias de reperfusión y a la administración precoz de BB, no obstante, entre un 6-8 % de los pacientes sufren TV o FV durante esta fase. La presentación típica de la arritmia es la TV inestable, frecuente, polimórfica y relativamente rápida que suele degenerar en FV. La reperfusión urgente es primordial, ya que la isquemia suele desencadenar estas arritmias. Se recomienda administrar BB siempre que no haya contraindicaciones. Puede ser necesaria la cardioversión eléctrica. Si no se logra un control adecuado, se debe considerar la administración i.v. de amiodarona. En caso de contraindicación a la amiodarona, se puede administrar lidocaína i.v., aunque no hay estudios comparativos sobre la superioridad de uno u otro fármaco en pacientes con IAMCEST. El valor pronóstico de la TV/FV en las primeras 48 horas tras un IAMCEST sigue siendo controvertido. Los datos disponibles indican que los pacientes con TV/FV precoz tienen un aumento de la mortalidad a los 30 días, pero no un aumento del riesgo de arritmias a largo plazo.
La TV o la FV pueden ocurrir en el momento de la restauración del flujo coronario (arritmias de reperfusión), pero no requieren tratamiento antiarrítmico específico debido a su curso benigno a largo plazo.
Las extrasístoles ventriculares son muy frecuentes en el primer día de la fase aguda y los complejos multiformes, salvas cortas o fenómeno de R sobre T son habituales. El valor de predicción de la FV es cuestionable y no requiere un tratamiento específico. La TV o la FV que se mantiene después de la fase aguda (normalmente 48 h desde la aparición de los síntomas de IAMCEST) y no se desencadena por isquemia recurrente implica mal pronóstico y, en estos casos debe evaluarse la conveniencia de implantar un desfibrilador automático implantable (DAI) para la prevención secundaria de la muerte súbita cardiaca. La prevención primaria de la muerte súbita con un DAI en los primeros 40 días tras el IAM en ausencia de TV/FV generalmente no está indicada. Se debe revaluar a los pacientes para tratamiento con DAI a las 6-12 semanas de la revascularización, aunque se puede considerar el implante de un DAI en pacientes con FEVI reducida preexistente para la prevención primaria incluso en la fase temprana tras el infarto. (Tabla 3).
Para la presentación de taquicardia ventricular sostenida (TVS):
- TV sostenida hemodinámicamente inestable: cardioversión con carga de 50-100 J.
- TV polimórfica:
En caso de que la QT basal sea normal: se administrará bloqueadora beta, amiodarona o lidocaína IV.
En caso de QT basal prolongado: se deben corregir electrolitos, considerar magnesio, sobrestimulación eléctrica, isoprenalina o lidocaína. (Para dosis de fármacos ver Tabla 1).
4.8.3 Fibrilación ventricular. (Ver GPC de Reanimación cardio-pulmo-cerebral)
4.8.4 Bradicardia sinusal y BAV.
La bradicardia sinusal es frecuente en las primeras horas del IAMCEST, sobre todo en los infartos inferiores. En algunos casos, los opiáceos son la causa de su ocurrencia. Normalmente no se precisa tratamiento. Si se acompaña de hipotensión grave, la bradicardia sinusal debe tratarse con atropina i.v.
El BAV de segundo grado tipo I (Mobitz I o Wenckebach) suele asociarse con infarto inferior y raramente causa efectos hemodinámicos adversos. Si los causara, se debe administrar atropina en primer lugar, cuando falle esta estrategia se debe usar estimulación eléctrica. El BAV de segundo grado tipo II (Mobitz II) y el BAV completo pueden ser indicaciones para marcapasos. Para los pacientes con BAV completo, infarto del VD y deterioro hemodinámico, se debe considerar la estimulación AV secuencial. El BAV asociado con infarto de la pared inferior suele ser suprahisiano y suele resolverse espontáneamente o tras la reperfusión.
El BAV asociado con infarto de la pared anterior suele ser infrahisiano y tiene una alta tasa de mortalidad por necrosis miocárdica extensa. Se debe insertar un electrodo de estimulación transvenosa en presencia de BAV avanzado con un ritmo de escape bajo, como ya se ha descrito, y considerar su uso en caso de aparición de bloqueo bifascicular o trifascicular. (Tabla 4).
5. Estratificación de riesgo.(3)
Estratificación del riesgo cardiovascular durante la estancia en la UCIC.
Pacientes con alto riesgo: aquellos con uno o más de los siguientes parámetros:
- Edad mayor de 70 años.
- Infarto de miocardio previo.
- Choque cardiogénico o hipotensión arterial mantenida.
- Edema agudo del pulmón.
- IAM de cara anterior.
- IAM de localización inferior o posterior y con toma de VD.
- BAV de alto grado.
- FA.
- FV.
- Paciente que no recibió tratamiento trombolítico.
Se realizará la primera evaluación del riesgo antes de los 10 minutos en el área roja del Servicio de Urgencias. La segunda evaluación del riesgo se realizará al llegar a la UCICor. Previo al alta del paciente es necesario redefinir el riesgo para evaluar posterior tratamiento intervencionista, son de mayor utilidad en pacientes clasificados previamente como de bajo riesgo y considerará datos aportados por:
• Ecocardiografía.
• Prueba ergométrica evaluativa pre-alta (se realizará a pacientes con IAM clasificados como de bajo riesgo y en edades menores de 65 años hombres y menores de 60 en las mujeres, 70-80 % de la FC máxima o limitada por síntomas). No solo por la información clínica que proporciona, sino también para tranquilizar al paciente muy aprensivo.
• Pacientes de alto riesgo: candidatos a angiografía.
• Turno en un mes para consulta de especializada con entrega del último ECG al paciente.
• Envío de hoja de egreso con información suficiente al médico de familia.
• Alta médica:
IAMCEST inferior no complicado al 6to día.
IAMCEST anterior no complicado al 7mo día.
6. Rehabilitación cardiovascular (RHC)
6.1 Definición: conjunto de actividades requeridas para garantizar las mejores condiciones posibles desde el punto de vista físico, mental y social, de manera que los pacientes puedan, por sus propios esfuerzos, retornar a la vida en comunidad lo más normalmente posible. No puede considerarse una forma aislada de terapéutica, sino que debe estar integrada en el tratamiento total del cual solo constituye una faceta y debe aplicarse tempranamente y ser continua.
Todos los pacientes que han sufrido un IAM deben tener acceso a la RHC.
6.2 Etapas de la RHC.
Etapa I: durante el ingreso hospitalario (etapa hospitalaria).
Etapa II: posterior al egreso hospitalario y hasta la reincorporación social o laboral del paciente (etapa de convalecencia). En la primera consulta especializada se redefine el riesgo del paciente. Se indica ergometría evaluativa precoz (entre 6 y 8 semanas), de no haberse realizado prealta, y se envía el paciente al área III, sitio donde se realiza la RHC.
Etapa III: de mantenimiento que debe mantenerse toda la vida.
6.3 RHC hospitalaria después del IAM y según riesgo cardiovascular:
Luego del diagnóstico de IAM:
Se realizará la primera evaluación del riesgo antes de los 10 minutos en el área roja del Servicio de Urgencias.
La segunda evaluación del riesgo se realizará al llegar a la UCIC:
Bajo riesgo:
Primeras 12 horas: se debe restringir la actividad física. En las primeras 12-24 horas se deben realizar movimientos pasivos y fisioterapia respiratoria, el paciente debe alimentarse solo.
A las 48 horas: se debe sentar en la cama al paciente y 15 minutos después si está asintomático se debe sentar en el sillón 2 veces al día.
Al tercer día, se realiza el traslado a la sección de cuidados intermedios y se debe sentar en la silla.
Ejercicio activo: ir al baño en silla de ruedas.
Al cuarto día: se deben realizar ejercicios activos de pie. El paciente debe permanecer sentado de 6 a 8 horas. Puede ir al baño caminando. Se traslada a sección de rehabilitación.
Al quinto día: de deben realizar ejercicios activos de pie y dar dos o tres vueltas en la habitación 3 veces al día.
Al sexto día: se deben realizar ejercicios activos de pie, caminar libremente. Ergometría pre-alta evaluativa submáxima (80 % de la FC máxima) o limitada por síntomas, si está indicada.
Esta fase participa activamente el técnico de fisioterapia.
Al séptimo día: se dará el alta médica.
7. Prevención secundaria (PrevS).
La enfermedad coronaria es un padecimiento crónico y los pacientes con IAM tienen alto riesgo de sufrir nuevos eventos y una muerte prematura. Este pronóstico puede mejorarse con intervenciones. En la presente guía ya se había mencionado a partir de la intervención psicológica precoz.(3,13)
- Abandono del tabaco: dejar de fumar es potencialmente la más efectiva de todas las medidas de PrevS. Sin exposición al tabaco en cualquiera de sus formas
- Dieta: aumentar el consumo de frutas, vegetales y pescado. Reducir la ingesta de grasas saturadas y sal (si el paciente padece de HTA).
- Actividad física: según lo recomendado en el programa de RHC. En general se recomienda realizar ejercicio físico aeróbico, de intensidad moderada durante 30 minutos al menos 4 veces por semana.
- Índice de masa corporal 20-25. Perímetro de cintura < 94 cm (varones) o < 80 cm (mujeres).
- Control de la HTA (< 140/90 mmHg) y la diabetes: HbA1c < 7 % (< 53 mmol/mol).
- Manejo del perfil lipídico: metas (Colesterol total < 5 mmol/l. CLDL (objetivo
principal) < 1,8 mmol/l. Colesterol HDL No hay cifra objetivo, pero > 1,0 mmol/l (> 40 mg/dl) para varones y > 1,2 mmol/l (> 45 mg/dl) para mujeres indican un riesgo más bajo y triglicéridos (no hay valor objetivo, pero < 1,7 mmol/l (< 150 mg/dl) indica un riesgo más bajo).(14) - Agentes farmacológicos: (Tabla 6).
8. Evaluación de la adherencia a la GPC.
Para evaluar el grado de consecución en el cumplimiento de la presente GPC se utilizará el siguiente instrumento de evaluación basado en lo recomendado por la anterior GPC(3) y con modificaciones realizadas tras nuevo consenso en el Servicio de Cardiología:(17)
Manejo en el Servicio de Urgencias (25 puntos).
- Paciente evaluado de máxima prioridad (Código Rojo): (5 puntos). Si el paciente acudió por sus medios y esperó en el Área amarilla por un período de 10 minutos o más se considera no clasificado de máxima prioridad.
- Alivio del dolor (opioides): (10 puntos).
- Obtención del ECG en un plazo hasta 10 minutos: (5 puntos). En caso de trombolisis extrahospitalaria se acota la demora que refleje el modelo enviado por el Área Intensiva Municipal (AIM).
- Resto de las medidas de urgencia (reposo horizontal, acceso venoso periférico, oxígeno no invasivo y monitorización eléctrica): (5 puntos). Se exige escrito en las indicaciones del Área Roja (y/o en el modelo enviado por el AIM.)
- Fibrinolisis (30 puntos).
- Tiempo puerta-aguja: para pacientes de Prioridad 1 menos de 30 minutos (10 puntos). Para los pacientes con Prioridad 2 menos de 45 minutos (10 puntos). Si la demora excedió estos tiempos no se dan puntos.
- Prioridad 1: pacientes en los que no hay ninguna duda de que deben ser tratados con fibrinolíticos (criterios clínicos y electrocardiográficos) y además presentan bajo riesgo de complicaciones, no existe ninguna condición asociada que contraindique en forma absoluta o relativa el tratamiento y por lo tanto no se justifica una demora en el inicio de la terapia trombolítica.
- Prioridad 2: pacientes en los cuales es necesario una valoración riesgo-beneficio antes de iniciar el tratamiento (por ejemplo: por existir comorbilidades como HTA en la presentación) lo que puede justificar una cierta demora).
- Tiempo síntomas–aguja: total 5 puntos (5 puntos si es menos de dos horas, 3 puntos si es entre 2 a 6 horas y 0 puntos si más de 6 horas).
- Doble terapia antiplaqueta previa (aspirina más clopidogrel a la dosis recomendada): (10 puntos)
- Protocolo completo de trombolisis descrito (hoja de trombolisis): (5 puntos).
- Trombolisis no realizada: si es debido a contraindicación absoluta (excepto factor tiempo) se otorgan los 30 puntos; si es debido a más de 12 horas de iniciados los síntomas (factor tiempo) se otorgan solo los 10 puntos correspondientes a la terapia antiplaqueta (inciso c de este acápite) y si no justificado (subutilización) se restan los 30 puntos.
- Manejo en sala: (45 puntos).
- Comentario del ECG a los 90 minutos de la trombolisis: (3 puntos).
- Heparina desde las primeras 24 horas: (10 puntos).
- Atorvastatina desde las primeras 24 horas: (10 puntos).
- BBA desde las primeras 24 horas: (5 puntos).
- IECA desde las primeras 24 horas: (5 puntos).
(En los incisos b, c, d y e, si existió contraindicación absoluta o el paciente falleció tempranamente se otorgaron los puntos).
- RHC intrahospitalaria incluyendo intervención psicológica: (5 puntos).
- Complementarios: total 7 puntos (Ecocardiograma 5 puntos y Lipidograma 2 puntos).
El grado de adherencia a la GPC se considerará adecuado, parcialmente adecuado e inadecuado (puntuación obtenida ≥ 80 puntos, entre 60 y 79 puntos o inferior a 60 puntos respectivamente).
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León.
2. Curación de datos: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León.
3. Análisis formal: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León, Claudio Rocdi Pérez Alfonso.
4. Adquisición de fondos: Esta investigación no contó con adquisición de fondos.
5. Investigación: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León, Claudio Rocdi Pérez Alfonso, Ginela León Valdés, Cynthia Torres Acosta.
6. Metodología: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León, Claudio Rocdi Pérez Alfonso, Ginela León Valdés, Cynthia Torres Acosta.
7. Administración del proyecto: Francisco de Jesús Valladares Carvajal.
8. Recursos: Ginela León Valdés, Cynthia Torres Acosta.
9. Software: Ginela León Valdés, Cynthia Torres Acosta.
10. Supervisión: Francisco de Jesús Valladares Carvajal.
11. Validación: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León, Claudio Rocdi Pérez Alfonso.
12. Visualización: Ginela León Valdés, Cynthia Torres Acosta.
13. Redacción del borrador original: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León, Claudio Rocdi Pérez Alfonso.
14. Redacción – revisión y edición: Francisco de Jesús Valladares Carvajal, Néstor Hernández de León, Claudio Rocdi Pérez Alfonso, Ginela León Valdés, Cynthia Torres Acosta.REFERENCIAS BIBLIOGRÁFICAS
- Ibáñez B, James S, Agewall S, Antunes MJ, Bucciarelli C, Bueno H, et al. Guía ESC 2017 sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST. Rev Esp Cardiol [revista en Internet]. 2017 [citado 16 Abr 2021];70(12):[aprox. 10p]. Disponible en: https://www.revespcardiol.org/es-guia-esc-2017-sobre-el-articulo-S0300893217306693 [Buscar en Google Scholar]
- Chandrashekhar Y, Narula J. Resource and Infrastructure-Appropriate Management of ST-Segment Elevation Myocardial Infarction in Low- and Middle-Income Countries. Circulation. 2020;141(1):2004-25 [Buscar en Google Scholar]
- Coll Y, Valladares FJ, González C. Infarto agudo de miocardio. Actualización de la Guía de Práctica Clínica. Finlay [revista en Internet]. 2016 [citado 1 Dic 2020];6(2):[aprox. 20p]. Disponible en: https://revfinlay.sld.cu/index.php/finlay/article/view/403 [Buscar en Google Scholar]
- Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Consenso ESC 2018 sobre la cuarta definición universal del infarto de miocardio. Rev Esp Cardiol [revista en Internet]. 2019 [citado 23 Feb 2021];72(1):[aprox. 15p]. Disponible en: https://www.revespcardiol.org/es-consenso-esc-2018-sobre-cuarta-articulo-S0300893218306365 [Buscar en Google Scholar]
- Libby P, Bornfeldt KE, Tall AR. Atherosclerosis: successes, surprises, and future challenges. Circ Res. 2016;118(4):531-4 [Buscar en Google Scholar]
- Anderson JL, Morrow DA. Acute Myocardial Infarction. N Engl J Med. 2017;376(21):2053-64 [Buscar en Google Scholar]
- Scirica BM, Libby P, Morrow DA. Infarto de miocardio con elevación del segmento ST: fisiopatología y evolución clínica. En: Zipes D, Libby P, Bonow R, Mann D, Tomaselli G. Braunwald Tratado de Cardiología: Texto de Medicina Cardiovascular [Internet]. 11na. ed. España: Elsevier; 2019 [citado 18 Ago 2020]. Disponible en: https://www.elsevier.com/books/braunwald-tratado-de-cardiologia/zipes/978-84-9113-398-8 [Buscar en Google Scholar]
- Borrayo G, Rosas M, Pérez G, Ramírez E, Almeida E, Arriaga JJ. Infarto agudo del miocardio con elevación del segmento ST: Código I. Rev Med Inst Mex Seguro Soc [revista en Internet]. 2018 [citado 1 Jul 2021];56(1):[aprox. 12p]. Disponible en: https://www.medigraphic.com/pdfs/imss/im-2018/im181e.pdf [Buscar en Google Scholar]
- Gaziano TA, Prabhakaran D, Gaziano JM. Repercusión global de las enfermedades cardiovasculares. En: Gaziano TA, Prabhakaran D, Gaziano JM. Braunwald Tratado de Cardiología: Texto de Medicina Cardiovascular [Internet]. 11na. ed. España: Elsevier; 2019 [citado 18 Nov 2021]. Disponible en: https://www.elsevier.com/books/braunwald-tratado-de-cardiologia/zipes/978-84-9113-398-8 [Buscar en Google Scholar]
- Ministerio de Salud Pública. Anuario Estadístico de Salud 2019 [Internet]. La Habana: MINSAP; 2020 [citado 6 Nov 2021]. Disponible en: https://temas.sld.cu/estadisticassalud/ [Buscar en Google Scholar]
- Navarro VR, Falcón A, Iraola MD, Valladares FJ, Ordúñez PO. Reducing case fatality from acute myocardial infarction in Cienfuegos, Cuba, 1994-2009. MEDICC Review. 2012;14(4):14-18 [Buscar en Google Scholar]
- Bonaca MP, Sabatine MS. Abordaje del paciente con dolor torácico. En: Bonaca MP, Sabatine MS. Braunwald Tratado de Cardiología: Texto de Medicina Cardiovascular. 11na. ed. España: Elsevier; 2019 [citado 18 Ago 2020]. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788480869560000551 [Buscar en Google Scholar]
- Rodríguez T. Contribución al desarrollo de la Psicocardiología en Cuba, como rama de la Psicología de la Salud. Finlay [revista en Internet]. 2016 [citado 25 Abr 2021];6(3):[aprox. 14p]. Disponible en: https://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S2221-24342016000300005&ing=es [Buscar en Google Scholar]
- Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315-81 [Buscar en Google Scholar]
- Gong FF, Vaitenas I, Malaisrie SC, Kameswari K. Mechanical Complications of Acute Myocardial Infarction. A Review. JAMA Cardiology. 2021;6(3):341-9 [Buscar en Google Scholar]
- Santos M, Ricardo E. Factores de riesgo de rotura cardiaca posterior al infarto del miocardio. Rev Cubana Med Inten Emergen [revista en Internet]. 2017 [citado 16 Mar 2021];16(4):[aprox. 5p]. Disponible en: https://www.revmie.sld.cu/index.php/mie/article/view/85-92/html_129 [Buscar en Google Scholar]
- Valladares FJ, Ravelo YC, De la Cruz L, González M. Adherencia a la guía de práctica clínica en pacientes con infarto agudo de miocardio con elevación del segmento ST y su relación con variables demográficas y clínicas. Finlay [revista en Internet]. 2020 [citado 10 May 2021];10(2):[aprox. 8p]. Disponible en: https://www.revfinlay.sld.cu/index.php/finlay/article/view/757 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129