Artículos originales
Comportamiento de la cognición y comorbilidad en pacientes con infarto cerebral hospitalizados. Seychelles 2010-2011
Cognition and Comorbidity Behavior in Hospitalized Patients Suffering from Stroke. Seychelles 2010-2011
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2012-03-07 09:23:51
Aprobado: 2012-09-22 10:16:11
Correspondencia: Armando Carlos Roca Socarras. Hospital General Universitario Vladimir Ilich Lenin. Holguín. aroca@hvil.hlg.sld.cu
RESUMEN
Objetivo: describir el comportamiento del deterioro cognitivo y de la comorbilidad en pacientes con infarto cerebral hospitalizados.
Método: estudio descriptivo de 77 pacientes con diagnóstico de enfermedad cerebrovascular isquémica, ingresados entre abril del 2010 y diciembre del 2011, en el hospital general de Seychelles. Se analizó el comportamiento de esta enfermedad en relación con variables como: edad, presencia de enfermedades crónicas no transmisibles, deterioro cognitivo, años de estudios terminados, hemisferio cerebral afectado y tiempo de evolución.
Resultados: el 68,9 % de los pacientes presentó deterior cognitivo; la edad media de estos fue de 74,2(±9,19) años frente a un 62,4(±14,2) para los que no tuvieron deterioro cognitivo. Se encontró una mayor frecuencia de enfermedades crónicas no transmisibles en los pacientes con deterioro cognitivo, con un índice de comorbilidad de Charlson en 2,11(±0,97). Se diagnosticaron con depresión 18 pacientes con deterioro cognitivo y 23 pacientes sin deterioro cognitivo.
Conclusiones: más de la mitad de los pacientes hospitalizados presentó deterioro cognitivo, la mayor parte previo a la enfermedad cerebrovascular. En este grupo de pacientes predominó el sexo masculino, se observó un incremento de la edad, de la severidad de la depresión, así como de la frecuencia de enfermedades crónicas no transmisibles, e infarto de tamaño considerable, con respecto a los pacientes sin deterioro cognitivo.
Palabras clave: cognición; comorbilidad; accidente cerebrovascular; trastornos del conocimiento
ABSTRACT
Objective: to describe the behavior of cognitive impairment and comorbidity in hospitalized patients suffering from stroke.
Method: descriptive study of 77 patients with ischemic stroke admitted from April 2010 to December 2011, in Seychelles General Hospital. The behavior of this disease in relation to variables such as age, presence of chronic noncommunicable diseases, cognitive impairment, educational level, affected cerebral hemisphere and time of evolution was analyzed.
Results: 68,9 % of patients presented cognitive impairment, their average age was 74,2 (± 9,19) years old compared to 62,4 (± 14,2) years old for those with no cognitive impairment. We found a higher frequency of chronic noncommunicable diseases in cognitively impaired patients with a Charlson comorbidity index of 2,11 (± 0,97). 18 patients with cognitive impairment and 23 patients with no cognitive impairment were diagnosed with depression.
Conclusions: more than half of hospitalized patients experienced cognitive impairment and in most cases previous to cerebrovascular disease. Male patients predominated. There was an increase in age, severity of depression, as well as in the frequency of chronic noncommunicable diseases, and myocardial infarction of considerable size, in respect to patients with no cognitive impairment.
Key words: cognition; comorbidity; stroke; cognition disorders
INTRODUCCIÓN
El riesgo de desarrollar una enfermedad cerebrovascular (ECV) o demencia en el curso de la vida, para individuos de 65 años o más, es de un tercio.1
En estudios comunitarios la prevalencia de demencia secundaria a un accidente cerebrovascular es aproximadamente de un 30 %, sin embargo, en estudios hospitalarios la prevalencia tiene rangos desde un 5,9 % hasta un 32 %, en dependencia de la edad media de la población estudiada, la demora entre el evento y la evaluación cognitiva, y los criterios diagnósticos utilizados.2
Estudios de incidencia, indican que el riesgo de demencia después de una ECV es más alto durante los primeros 6 a 12 meses, en comparación con la población general.2 La demencia secundaria a la ECV es una categoría importante dentro del deterioro cognitivo vascular (DCV).
Además de la relación con la carga vascular, este tipo de demencia se relaciona también con la carga degenerativa del cerebro. El accidente cerebrovascular inicia una exacerbación vascular que incrementa la probabilidad de un diagnóstico clínico de demencia en pacientes con enfermedad de Alzheimer subclínica, fundamentalmente en los adultos mayores.3
Los hallazgos patológicos propios de la enfermedad de Alzheimer y la demencia vascular, han sido reportados en un porcentaje elevado de casos diagnosticados clínicamente tanto con una condición, como con la otra. Infartos y lesiones de la sustancia blanca son hallados en el 60 % al 90 % de pacientes con enfermedad de Alzheimer, así como placas y ovillos neurofibrilares son encontrados en más de la tercera parte de los casos diagnosticados con DCV.4
Debido a su implicación clínica en la prevención de la demencia en pacientes con ECV, es esencial determinar si el deterioro cognitivo (DC) es el efecto de un proceso subyacente exacerbado por la enfermedad, o si es el resultado del accidente cerebrovascular.5
El objetivo de este trabajo es: describir el comportamiento del deterioro cognitivo y de la comorbilidad en pacientes con infarto cerebral hospitalizados.
MÉTODO
Se realizó un estudio descriptivo, en el período comprendido entre abril del 2010 y diciembre del 2011, de 77 pacientes admitidos en el Hospital de North East Point Mahe, Seychelles, para tratamiento de rehabilitación y asistencia de respiro.
Se incluyeron todos los pacientes con diagnóstico clínico y por imagen (tomografía axial computarizada) de ECV isquémica con al menos una semana de evolución después del accidente cerebrovascular. También se incluyeron pacientes con enfermedades cerebrovasculares previas (ECVp) de tipo isquémicas, DC (2), dificultades para escribir y con el lenguaje. Se excluyeron los pacientes con diagnóstico de ECV hemorrágica, tanto en los antecedentes (3) como cuando esta fue el último evento (9), aquellos con enfermedades terminales (1 caso con cáncer en estado terminal), con historia de trauma craneal severo o de neurocirugía (2 casos con hematoma subdural crónico), psicosis y retraso mental (1 caso con psicosis y otro con retraso mental), así como los pacientes que no contaron con un informador fiable para responder el Test del informador.4
Se analizó el comportamiento de esta enfermedad en relación con variables como: edad, presencia de enfermedades crónicas no transmisibles, DC, años de estudios terminados, hemisferio cerebral afectado (derecho, izquierdo, bilateral) y tiempo de evolución (semanas).
Para determinar la existencia de DC se utilizó el Mini examen cognitivo de Folstein con un punto de corte en 24 puntos, y el Test del informador (IQCODE) con un punto de corte en 3,4 para su versión abreviada en inglés de 16 preguntas. Se consideró la existencia de DC, cuando la puntuación estuvo por debajo del punto de corte en una de las dos pruebas.
Para analizar la variable edad, se conformaron grupos de edades.
Se evaluó la presencia de enfermedades crónicas no transmisibles de acuerdo a criterios diagnósticos para la hipertensión arterial (HTA), insuficiencia cardiaca congestiva (ICC), diabetes mellitus (DM), cardiopatía isquémica (CaI), enfermedad cerebrovascular previa (ECVp), insuficiencia renal crónica (IRC), insuficiencia arterial periférica (IAP), enfermedad pulmonar obstructiva crónica (EPOC), el cáncer y la depresión.
Además se utilizó la Escala de depresión geriátrica de Yesavage (versión abreviada),6 el índice de comorbilidad de Charlson (versión abreviada),7 y la clasificación del accidente cerebrovascular isquémico (TOAST, por sus siglas del inglés Trial of Org 10172 in Acute Stroke Treatment)8 para los diferentes subtipos de ECV isquémica. La escala de Yesavage no se aplicó a los pacientes con puntuaciones en el Folstein iguales o menores de 14 puntos, en la evaluación del índice de comorbilidad de Charlson se incluyó la ECVp y la demencia. En la clasificación TOAST se tuvo en cuenta el último episodio.
La información sobre motivo de ingreso, edad, sexo, tiempo de evolución, años de estudio, tipo de ECV y resultados tomográficos, registros de los diferentes índices utilizados y enfermedades crónicas no trasmisibles, se obtuvieron de las historias clínicas individuales de los pacientes. El IQCODE se realizó como parte de la historia clínica con la información proveniente de los familiares y cuidadores de pacientes.
La realización de este estudio contó con la aprobación del Comité de Ética del Ministerio de Salud de la República de Seychelles y el consentimiento informado de los familiares y cuidadores de los pacientes.
Para la interpretación y análisis de los datos se confeccionaron tablas multivariantes de asociación de variables, se expresan los resultados en números absolutos y porcentajes, medidas de tendencia central (media), variabilidad [desviación estándar (DE)] y correlación no paramétrica [Chi cuadrado (x2) con test exacto de Fisher y corrección de Yates, coeficiente rho de Spearman, prueba U de Mann Whitney, con un nivel de significación de 0,05.
El procesamiento de los datos se realizó con el paquete estadístico SPSS 17 para Windows.
RESULTADOS
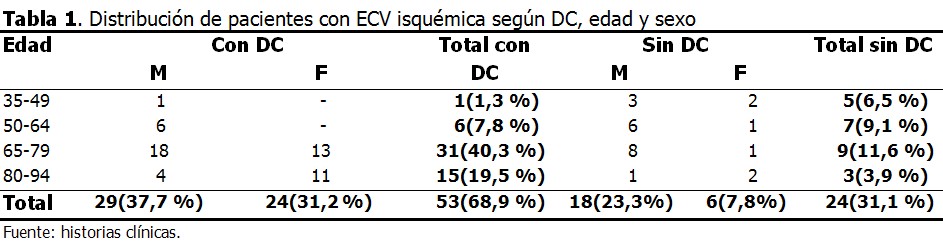
El rango de edades estuvo entre 39-87 años en los pacientes con DC, y de 42 a 88 años en los que no tuvieron DC. El coeficiente rho de Spearman mostró en los pacientes con DC una correlación positiva media (0,65) con respecto a la edad, y en los pacientes sin DC una correlación negativa débil (-0,2). (Tabla 1).
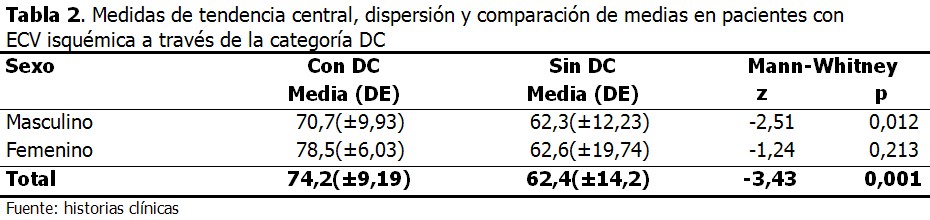
Existió independencia entre cognición y sexo [x2=2,85; p=0,09; Yates(x2=2,07;p=0,15)]. (Tabla 2).
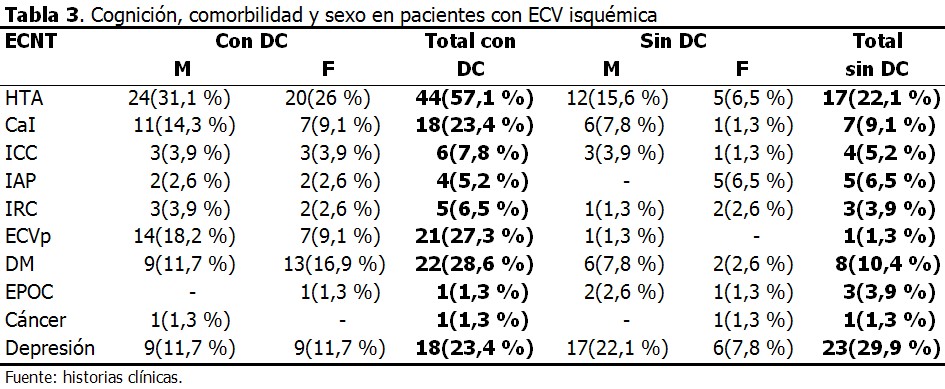
Las ECNT no mostraron asociación con la ECV en general, ni con el DC en particular, tanto con el Chi cuadrado (realizado para todas las enfermedades) como el test exacto de Fisher (realizado en la HTA, DM y la depresión). (Tabla 3).
De los 22 pacientes con infartos previos, 21 presentaron DC y representaron el 39,6 % del total de pacientes con DC, sin embargo, no hubo asociación entre el DC y el número de infartos al analizarlo con el Chi cuadrado (x2=2,03; p=0,15). Estos 21 pacientes con DC e infartos previos, tuvieron una edad media de 73,1 (±10,2) Charlson 2,05(±0,9) Yesavage 6,8(±1,5) Folstein 9,3(±5,6) y el IQCODE 4,4(±0,39). Entre estos pacientes se encontraron 2 con antecedentes de cuadro demencial sin definir tipo, y constituyeron los únicos casos documentados en la muestra estudiada.
La correlación rho de Spearman, mostrada por los pacientes con DC a través del Folstein, fue la siguiente: con el índice de Charlson fue de 0,059 (correlación positiva débil), y con la Escala de Yesavage fue de -0,2 (correlación negativa débil). En el caso de los pacientes sin DC fue de 0,002 con el índice de Charlson (correlación positiva débil), y de 0,1 (correlación positiva débil) con la Escala de Yesavage. Por otra parte, en 44 pacientes (el 83 % de los afectados por DC y el 57,1 % del total con ECV) se obtuvieron registros con el IQCODE que ubicaron el DC previo al último infarto cerebral. En 9 pacientes (17 % de los casos con DC y el 11,7 % del total con ECV) se registraron puntuaciones que sugirieron la presencia de DC posterior a la ECV. El coeficiente rho de Spearman mostró una correlación negativa muy fuerte (-0,9) entre el Folstein y el IQCODE en los pacientes con DC, y una correlación negativa considerable (-0,86) en los pacientes con ausencia de DC. No existió una diferencia significativa entre la respuesta a la escala de Yesavage por los pacientes con DC y la respuesta de los pacientes sin DC [Mann Whitney (z= -1,714; p=0,086)]. Tampoco se encontraron diferencias significativas en la respuesta al índice de comorbilidad de Charlson [Mann Whitney (z=-0,052; p=0,958)]. (Tabla 4).
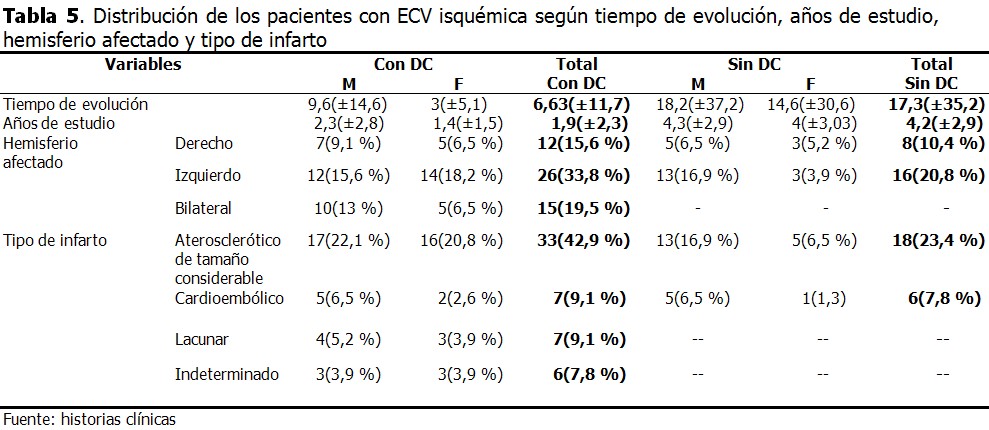
La comparación de las medias a través de la categoría tiempo de evolución, entre los pacientes con y sin DC, no fue significativa (z=-0,751; p=0,453). Por otra parte, el coeficiente rho de Spearman mostró una correlación positiva débil (0,17) entre el Folstein y los años de estudio. No obstante, la comparación de las medias a través de la categoría años de estudio con el test U de Mann Whitney, arrojó diferencias significativas (z=-2,972; p=0,003). Por último, la prueba Chi cuadrado evidenció independencia entre el tipo de infarto y la presencia de DC [x2=0,96;p=0,81; Fisher (p=0,093)], al igual que en el caso del hemisferio afectado [x2=1,7;p=0,42; Yates (x2=0,9;p=0,63)]. (Tabla 5).
DISCUSIÓN
En la medida en que las personas viven más, la carga del DC en las sociedades se incrementa de forma importante. El DC en relación con la demencia vascular se incrementa después de los 65 años y es más frecuente en menores de 80 años, si se sigue el patrón de la ECV. Algunos estudios reportan mayor incidencia en hombres que en mujeres. El resto de los subtipos de demencia, fundamentalmente la enfermedad de Alzheimer, también duplican su prevalencia por cada lustro por encima de los 65 años, y se presentan con mayor frecuencia en mujeres que en hombres.
En general, la edad media de los pacientes estudiados coincidió con autores como: Serrano,9 Srikanth,10 Sachdev11 y Del Ser.12 Fue superior a la reportada por Melkas13 y Fernández,14 e inferior a la descrita por Ivan15 y Barba.16
Los autores encontraron una diferencia significativa en las edades de los pacientes con DC, con respecto a los que no lo presentaron. Este resultado ha sido corroborado por los estudios de Srikanth,10 Fernández14 y Hébert.17
Además se describieron 6 pacientes con ECV isquémica menores de 50 años, y de ellos un caso con DC. Esta enfermedad tiene importantes consecuencias para la calidad de vida de los pacientes; pero cuando se trata de personas jóvenes con proyectos de vida incompletos, en período de formación de familias, consolidando su mejor desempeño en determinadas profesiones, una vida social activa y varias décadas de vida por vivir, sus consecuencias son devastadoras. Por otra parte, el riesgo de recurrencia y mortalidad se agrava en edades más tempranas, esta última asociada a la aparición de DC.
En relación con el sexo, la investigación coincide con Serrano9 y Chau,18 y no coincide con la mayor parte de los autores consultados como Sachdev,11 Melkas,13 Fernández,14 Barba,16 de Weerd19 y Hénon.20
La hospitalización después de un infarto cerebral no es la única opción de rehabilitación y de asistencia que tienen los pacientes en Seychelles, y quizás factores sociales influyeron en el mayor número de ingresos masculinos como: la falta de medios materiales, transporte, disponibilidad de tiempo y ausencia de cuidadores, por citar algunos ejemplos. Sin embargo, la identificación de estos problemas no estuvo entre los objetivos del estudio. En futuras investigaciones se puede profundizar en estos aspectos y su asociación con la distribución mostrada por sexo.
Dos de los estudios mencionados utilizaron instrumentos para medir riesgo social en los pacientes y arrojaron resultados diferentes respecto al sexo.18,19
En este estudio se observó un mayor número de pacientes con DC entre los portadores de HTA, CaI, ICC, IRC, ECVp y DM, enfermedades que han sido relacionadas con la ECV isquémica, el deterioro cognitivo vascular21-23 y por la enfermedad de Alzheimer.24-26
La depresión ha sido descrita en estrecha relación con la ECV,19, 27, 28 el deterioro cognitivo vascular14, 23, 29 y la demencia tipo Alzheimer.30
La depresión puede tener influencia determinante en las funciones cognitivas e imitar al DC. Además, la depresión debe ser valorada como una causa de comorbilidad, un factor prodrómico, o una consecuencia del deterioro cognitivo vascular. Si se tiene en cuenta lo anterior y el número de pacientes con ECV previa y DC, los autores de esta investigación analizaron que quizás las diferencias encontradas entre el registro de Yesavage en los grupos con y sin DC, respondan a la comorbilidad presentada por estos pacientes. En la depresión vascular se ha descrito la afectación de la sustancia blanca y gris subcortical, en la enfermedad de Alzheimer la depresión está causada por cambios degenerativos en las áreas cerebrales que controlan el estado afectivo.
En relación con el índice de comorbilidad de Charlson se describieron resultados que no implican diferencias significativas entre los pacientes, a pesar de la mayor frecuencia de algunas enfermedades mencionadas anteriormente en los casos que estuvo presente el DC.
Sin embargo, el índice de Charlson que se obtuvo en el estudio es bastante alto para pacientes con ECV isquémica, si se considera que cada punto está asociado con un 15 % de posibilidades de una evolución desfavorable y mortalidad después del alta.31 Al comparar con la bibliografía consultada, estuvo por encima con respecto al de los pacientes estudiados por Goldstein,31 Tang,32 Huanguang,33 y Volpato.34
Los resultados del IQCODE y el análisis del tiempo de evolución arrojaron, que la mayor parte de los pacientes tuvieron cierto grado de DC anterior al último infarto cerebral. En ello influye que la mitad de estos pacientes tuvieron infartos cerebrales previos (15 de ellos con lesiones bilaterales), el incluir pacientes con demencia previa en el estudio, y la dependencia que tiene el IQCODE de la opinión del informante. No obstante, el instrumento tuvo una correlación negativa entre considerable y muy fuerte con el Folstein. Los resultados son superiores a los de otras investigaciones que han analizado el DC previo a la ECV, como Melkas,13 Barba16 y Hénon.20
Otro factor que no se debe menospreciar, es la respuesta al Folstein de los pacientes con ECV con o sin DC, pero con una elevada frecuencia de depresión, registrada por el estudio. Esta se convierte en un problema, si se tiene en cuenta que el comportamiento del paciente deprimido puede influenciar de forma marcada la respuesta a los test cognitivos. No obstante, algunos síntomas relacionados con la depresión pueden revertirse con el tratamiento, por lo tanto, puede ocurrir una mejoría del DC. Por otra parte, la mayoría de los pacientes fueron evaluados temprano después del accidente cerebrovascular, y es posible que tuvieran una mejoría de la cognición de forma gradual como parte del proceso de recuperación de la ECV. Quizás con un estudio longitudinal y evaluaciones sucesivas a los 3, 6 y 12 meses, los resultados obtenidos con el Folstein no denotarían DC, o de existir, sería de menor severidad. La suma de los aspectos señalados influye de manera importante en los resultados de los test cognitivos y deben valorarse en futuras investigaciones.
Los autores describieron un menor nivel educacional en los pacientes con DC, al compararlos con los pacientes en que estuvo ausente. Aunque fue significativa la diferencia, existió una correlación positiva débil entre el DC y los años de estudio. Autores como Liao, en pacientes con Alzheimer,35 y Sachdev,11 en adultos mayores con DCV, han planteado la relación con el bajo nivel educacional, que constituye un factor de riesgo para la demencia en general. La hipótesis de la reserva cognitiva sugiere que a mayor cantidad de años de estudios, asociados a ciertas condiciones y actividades ocupacionales y de pasatiempo estimuladoras de las funciones cognitivas, pueden conducir a conexiones sinápticas mejores, y a una utilización más eficaz de los circuitos cerebrales alternativos para el desempeño de tareas cognitivas. Por lo tanto, una mayor educación y estilos de vida con más estimulación cognitiva, pueden retardar o disminuir las manifestaciones clínicas de demencia.
A pesar de algunos elementos señalados anteriormente, fueron descritos una serie de factores que soportan la alta frecuencia de pacientes con DC, como: una edad avanzada, presencia de DM (22 pacientes), bajo nivel educacional (diferencia significativa con respecto a los pacientes sin DC), presencia de DC previo, infarto de considerable tamaño (último evento), e historia de ECVp y lesiones bilaterales. Esto concuerda con la mayor parte de la bibliografía revisada.15, 36, 37
Dentro de las limitaciones del estudio, el idioma constituyó una de ellas. La aplicación de los instrumentos para determinar la presencia de DC se realizó desde la comunicación en inglés y se realizó la traducción según el idioma del paciente o acompañante. Estos instrumentos no han sido validados para la población del archipiélago, lo cual sería bastante difícil en un pequeño país que tiene tres idiomas oficiales. La naturaleza del estudio, que no permitió evaluaciones longitudinales del paciente, fue otras de las limitaciones. También la utilización del Folstein en una población con bajo nivel educacional, dificultades en el lenguaje y posible deterioro cognitivo vascular, son otras de las limitaciones del estudio. El Folstein fue diseñado para detectar deterioro cognitivo en pacientes con Alzheimer, aunque ha sido ampliamente utilizado en numerosas investigaciones para la evaluación del paciente con enfermedad cerebrovascular. Por último, el IQCODE es bastante dependiente de la opinión del informante y de su relación e intereses respecto al enfermo, lo cual tiene su efecto en las respuestas.
La investigación mostró que más de la mitad de los pacientes hospitalizados presentaban DC, la mayor parte previo a la ECV. En este grupo de pacientes predominó el sexo masculino, las edades fueron más elevadas, los niveles de depresión más severos, las frecuencias de HTA, CaI, ICC, IRC, ECVp, DM e infarto aterosclerótico de tamaño considerable, también fueron mayores, en comparación con las de pacientes sin DC.
REFERENCIAS BIBLIOGRÁFICAS
- Seshadri S, Beiser A, Kelly-Hayes M, Kase CS, Au R, Kannel WB, et al. The lifetime risk of stroke: estimates from the Framingham Study. Stroke. 2006;37(2):345-50 [Buscar en Google Scholar]
- Leys D, Hénon H, Mackowiak-Cordoliani MA, Pasquier F. Poststroke dementia. Lancet Neurol. 2005;4(11):752-9 [Buscar en Google Scholar]
- Snowdon DA, Greiner LH, Mortimer JA, Riley KP, Greiner PA, Markesbery WR. Brain infarction and the clinical expression of Alzheimer disease. The Nun Study. JAMA. 1997;277(10):813-7 [Buscar en Google Scholar]
- Marshall RS, Lazar RM. Pumps, aqueducts, and drought management: vascular physiology in vascular cognitive impairment. Stroke. 2011;42(1):221-6 [Buscar en Google Scholar]
- Reitz C, Bos MJ, Hofman A, Koudstaal PJ, Breteler MB. Prestroke cognitive performance, incident stroke, and risk of dementia: the Rotterdam Study. Stroke. 2008;39(1):36-41 [Buscar en Google Scholar]
- Yesavage JA, Shelk JI. Geriatric Depression Scale (GDS):recent evidence and development of a shorter version. Clinical Gerontologist. 1986;5(1-2):165-73 [Buscar en Google Scholar]
- Berkman LF, Leo-Summers L, Horwitz RI. Emotional support and survival after myocardial infarction. A prospective, population-based study of the elderly. Ann Intern Med. 1992;117(12):1003-9 [Buscar en Google Scholar]
- Adams HP, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24(1):35-41 [Buscar en Google Scholar]
- Serrano S, Domingo J, Rodríguez-García E, Castro MD, del Ser T. Frequency of cognitive impairment without dementia in patient with stroke: a two-years follow-up study. Stroke. 2007;38(1):105-10 [Buscar en Google Scholar]
- Srikanth VK, Quinn SJ, Donnan GA, Saling MM, Thrift AG. Long-term cognitive transitions, rates of cognitive change, and predictors of incident dementia in a population-based first-ever stroke cohort. Stroke. 2006;37(10):2479-83 [Buscar en Google Scholar]
- Sachdev PS, Brodaty H, Valenzuela MJ, Lorentz L, Looi J, Berman K, et al. Clinical determinants of dementia and mild cognitive impairment following ischaemic stroke: the Sidney Stroke study. Dement Geriatr Cogn Disord. 2006;21(5-6):275-83 [Buscar en Google Scholar]
- Del Ser T, Barba R, Morin MM, Domingo J, Cemillan C, Pondal M, et al. Evolution of cognitive impairment after stroke and risk factors for delayed progression. Stroke. 2005;36(12):2670-5 [Buscar en Google Scholar]
- Melkas S, Oksala NK, Jokinen H, Pohjasvaara T, Vataja R, Oksala A, et al. Postroke dementia predicts poor survival in long-term follow-up: influence of prestrike cognitive decline and previous stroke. Neurol Neurosurg Psychiatry. 2009;80(8):865-70 [Buscar en Google Scholar]
- Fernández O, Rojas J, Pando A, Marrero M, Mesa Y, Santiesteban N, et al. Deterioro cognitivo después de un infarto cerebral: frecuencia y factores determinantes. Rev Neurol. 2008;46(6):326-30 [Buscar en Google Scholar]
- Ivan CS, Seshedri S, Beiser A, Au R, Kase CS, Kelly-Hayes M, et al. Dementia after stroke: the Framingham Study. Stroke. 2004;35(6):1264-8 [Buscar en Google Scholar]
- Barba R, Martínez S, Rodríguez E, Pondal M, Vivancos J, Del Ser T. Poststroke dementia. Clinical features and risk factors. Stroke. 2000;31(7):1494-501 [Buscar en Google Scholar]
- Hébert R, Lindsay J, Verreault R, Rockwood K, Hill G, Dubois MF. Vascular dementia: incidence and risk factors in the Canadian study of health and aging. Stroke. 2000;31(7):1487-93 [Buscar en Google Scholar]
- Chau JP, Thompson DR, Twinn S, Chang AM, Woo J. Determinants of participation restriction among community dwelling stroke survivors: a path analysis. BMC Neurol. 2009;9:49 [Buscar en Google Scholar]
- De Weerd L, Rutgers WA, Groenier KH, van der Meer K. Perceived wellbeing of patients one year post stroke in general practice-recommendations for quality aftercare. BMC Neurol. 2011;11:42 [Buscar en Google Scholar]
- Hénon H, Pasquier F, Durieu I, Godefrey O, Lucas C, Lebert F, et al. Preexisting dementia in stroke patients. Baseline frequency, associated factors, and outcome. Stroke. 1997;28(12):2429-36 [Buscar en Google Scholar]
- Gorelick PB, Scuteri A, Black SE, DeCarli C, Greenberg SM, Iadecola C, et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011;42(9):2672-713 [Buscar en Google Scholar]
- Murray AM. Cognitive impairment in the aging dialysis and chronic kidney disease population: an occult burden. Adv Chronic Kidney Dis. 2008;15(2):123-32 [Buscar en Google Scholar]
- Lavretsky H, Zheng L, Weiner MW, Mungas D, Reed B, Kramer JH, et al. Association of depressed mood and mortality in older adults with and without cognitive impairment in a prospective naturalistic Study. Am J Psychiatry. 2010;167(5):589-97 [Buscar en Google Scholar]
- Dickstein DL, Walsh J, Brautigam H, Stockton SD, Gandy S, Hof PR. Role of vascular risk factors and vascular dysfunction in Alzheimer s disease. MT Sinai J Med. 2010;77(1):82-102 [Buscar en Google Scholar]
- Ericksson UK, Bennet AM, Gatz M, Dickman PW, Pedersen NL. Nonstroke cardiovascular disease and risk of Alzheimer disease and dementia. Alzheimer Dis Assoc Disord. 2010;24(3):213-9 [Buscar en Google Scholar]
- Craft S. The role of metabolic disorders in Alzheimer s disease and vascular dementia: two roads converged. Arch Neurol. 2009;66(3):300-5 [Buscar en Google Scholar]
- Teper E, O Brien JT. Vascular factors and depression. Int J Geriatr Psychiatry. 2008;23(10):993-1000 [Buscar en Google Scholar]
- Chatterjee K, Fall S, Barer D. Mood after stroke: a case control study of biochemical, neuro-imaging and socio-economic risk factors for major depression in stroke survivors. BMC Neurol. 2010;10:125 [Buscar en Google Scholar]
- Park JH, Lee SB, Lee TJ, Lee DY, Jhoo JH, Youn JC, et al. Depression in vascular dementia is quantitatively and qualitatively different from depression in Alzheimer s disease. Dement Geriatr Cogn Disord. 2007;23(2):67-73 [Buscar en Google Scholar]
- Aalten P, Verhey FR, Boziki M, Brugnolo A, Bullock R, Byrne EJ, et al. Consistency of neuropsychiatric syndromes across dementias: results from the European Alzheimer Disease Consortium. Part II. Dement Geriatr Cogn Disord. 2008;25(1):1-8 [Buscar en Google Scholar]
- Goldstein LB, Samsa GP, Matchar DB, Horner RD. Charlson index comorbidity adjustment for ischemic stroke outcome studies. Stroke. 2004;35(8):1941-5 [Buscar en Google Scholar]
- Tang J, Wan JY, Bailey JE. Performance of comorbidity measures to predict stroke and death in a community-dwelling, hypertensive Medicaid population. Stroke. 2008;39(7):1938-44 [Buscar en Google Scholar]
- Jia H, Zheng Y, Reker DM, Cowper DC, Wu SS, Vogel WB, et al. Multiple system utilization and mortality for veterans with stroke. Stroke. 2007;38(2):355-60 [Buscar en Google Scholar]
- Volpato S, Maraldi C, Blé A, Ranzini M, Ritta Atti A, Dominquez LJ, et al. Prescription of antithrombotic therapy in older patients hospitalized for transient ischemic attack and ischemic stroke: The GIFA study. Stroke. 2004;35(4):913-7 [Buscar en Google Scholar]
- Liao YC, Liu RS, Lee ET, Lee YC, Wang PN, Lin KN, et al. Cognitive reserve: A SPECT study of 132 Alzheimer’s disease patients with an education range of 0-19 years. Dement Geriatr Cogn Disord. 2005;20(1):8-14 [Buscar en Google Scholar]
- Pendlebury ST, Rothwell PM. Prevalence, incidence, and factors associated with pre-stroke and post-stroke dementia: a systematic review and meta-analysis. Lancet Neurol. 2009;8(11):1006-18 [Buscar en Google Scholar]
- Tang WK, Chan SS, Chiu HFK, Ungvari GS, Wong KS, Kwok CY, et al. Frequency and determinants of poststroke dementia in Chinese. Stroke. 2004;35(4):930-5 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129