Artículos especiales
Las enfermedades crónicas no transmisibles y la pandemia por COVID-19
Non-communicable Chronic Diseases and the COVID-19 Pandemic
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2020-05-06 11:01:48
Aprobado: 2020-05-07 15:21:15
Correspondencia: Miguel Ángel Serra Valdés. Hospital General Docente Enrique Cabrera. La Habana. maserra@infomed.sld.cu
RESUMEN
Palabras clave: enfermedades no transmisibles; enfermedad crónica; infecciones por coronavirus; coronavirus; pandemias
ABSTRACT
Key words: non-communicable diseases; chronic disease; coronavirus infections; coronavirus; pandemics
INTRODUCCIÓN
En los últimos 40 años, la humanidad se ha visto afectada por tres pandemias de envergadura que han cobrado muchas muertes: el aumento de la incidencia y las tasas de prevalencia de las enfermedades crónicas no transmisibles (ECNT), la pandemia de la enfermedad por el virus de inmunodeficiencia humana-sida (VIH/sida) y en la actualidad la pandemia provocada por la COVID-19.
La COVID-19 es una enfermedad infectocontagiosa viral emergente con elevada mortalidad, que ha contribuido a elevar la mortalidad por las ECNT en muy corto tiempo. Es esta una enfermedad altamente contagiosa y que ha producido un colapso de los sistemas sanitarios de todo el mundo.
Las enfermedades crónicas no transmisibles (ECNT) constituyen en la actualidad uno de los mayores retos que enfrentan los Sistemas de Salud a nivel mundial. Las estadísticas publicadas en los Anuarios Estadísticos de Salud de Cuba y de la Organización Mundial de la Salud (OMS) son alarmantes y preocupantes. La morbilidad y mortalidad por ECNT se incrementa prácticamente por años, no solo con el envejecimiento poblacional al aumentar la expectativa de vida, sino que se incrementa en edades muy activas de la vida.
Según las estadísticas de la OMS, más de 40 millones de personas mueren anualmente por ECNT y son las principales causas de fallecimiento, las enfermedades cardiovasculares (17,7 millones cada año), seguidas del cáncer (8,8 millones), las enfermedades respiratorias (3,9 millones) y la diabetes (1,6 millones). Estos cuatro grupos de padecimientos son responsables de más del 80 % de todas las muertes prematuras por ECNT.(1-3)
Hoy, en 2020, la OMS alerta sobre el incremento aún mayor para la presente década que comienza.(1) Lo son por varias razones: el gran número de casos afectados con sus consabidas tasas de incidencia cada vez más crecientes, su gradual contribución a la mortalidad general, porque son la causa más frecuente de discapacidad, por el costo elevado de la hospitalización, el de su tratamiento médico y el de su posterior rehabilitación. Su emergencia como problema de salud pública sigue siendo el resultado de varios factores: cambios sociales, culturales, políticos y económicos que modificaron el estilo y condiciones de vida de un gran porcentaje de la población a escala universal: los determinantes sociales de la salud.(2)
La Agenda de Salud Sostenible para las Américas 2018-2030, en el Objetivo 9 señala para las enfermedades no transmisibles:(…) “el propósito de este objetivo es reducir la carga de las enfermedades no transmisibles, incluidas las enfermedades cardiovasculares, la enfermedad cerebrovascular, el cáncer, las enfermedades respiratorias crónicas, la obesidad, la diabetes, la enfermedad renal crónica, los trastornos de salud mental y la demencia, hepatopatías crónicas, enfermedades neurológicas crónicas de base inmune, las enfermedades reumáticas, así como la discapacidad que estas provocan. Esto se puede lograr mediante la promoción de la salud y la reducción de los riesgos, así como la prevención, el tratamiento y la vigilancia de las enfermedades no transmisibles y sus factores de riesgo”. (4) Este proceso se ha visto afectado en los últimos meses por la aparición de un nuevo virus emergente con alta contagiosidad y mortalidad: el SARS-CoV-2 o COVID-19. La mayor mortalidad de los casos se observa en pacientes portadores de algunas ECNT, sobre todo mayores de 60 años, los cuales algunos ya consideran como factores de riesgo para contraer la enfermedad y riesgo 10 veces más de morir.(5-8)
El objetivo del presente artículo es dar a conocerla la relación entre las ECNT y la COVID-19. La aparición de este padecimiento contribuye a aumentar la mortalidad de quienes padecen ECNT. En este artículo se pretende hacer un resumen analítico de las mejores evidencias científicas disponibles hasta la fecha de su confección.
DESARROLLO
Para entender el porqué del incremento de los casos graves y críticos de la enfermedad en mayores de 60 años, sobre todo, y con ECNT y del aumento de la mortalidad, se debe revisar la patogenia de este nuevo virus en el organismo. De ello derivan las consecuencias.
- Síntesis de los efectos de la COVID-19 al penetrar en el organismo. Patogenia
Una vez que el virus penetra por las vías aéreas superiores con síntomas leves o sin síntomas parece tomar algunos caminos desde allí, ya sea estableciéndose en los pulmones, abriéndose camino hacia el tracto digestivo, haciendo una combinación de ambos y a otros órganos. Desciende a los pulmones a través del árbol traqueo-bronquial donde infecta el epitelio ciliado y finalmente los neumocitos. El receptor principal del coronavirus es la ECA2, aunque el virus también se une a dos lectinas de tipo C expresadas en células dendríticas, DC-SIGN y LSIGN y el receptor DPP4. Se hallan en diversos tipos celulares, como las células epiteliales bronquiales no ciliadas, otras epiteliales de vías respiratorias altas, las epiteliales alveolares y las células endoteliales de los vasos a este nivel. Existen también receptores EAC2 en el miocardio, riñones, hígado y sistema nervioso central. El receptor DPP4 también se encuentra en células epiteliales del riñón, del intestino delgado, del hígado, páncreas y de la próstata, así como en leucocitos activados. Durante la fase aguda de la enfermedad produce la liberación de citoquinas y quimiocinas responsables del efecto patogénico y fueron identificadas por científicos norteamericanos:IL1B, IL1RA, IL2, IL4, IL5, IL6, IL7, IL8 (también conocido como CXCL8), IL9, IL10, IL12p70, IL13, IL15, IL17A, Eotaxin (también conocido como CCL11), FGF2 básico, GCSF (CSF3), GMCSF (CSF2), IFNγ, IP10 (CXCL10), MCP1 (CCL2), MIP1A (CCL3), MIP1B ( CCL4), PDGFB, RANTES (CCL5), TNFα y VEGFA. La inundación de estos productos químicos puede desencadenar lo que se conoce como una "tormenta de citoquinas".(9-20)
Las citoquinas y quimiocinas son responsables de la respuesta inflamatoria pulmonar pero también del proceso inflamatorio del endotelio de los vasos sanguíneos. En la primera es responsable del cuadro de neumonía viral reportado desde el inicio de los casos, al cual se suma posteriormente con los días como complicación sobre-infección bacteriana que lo hace más grave. En segundos se afecta la microvasculatura con inflamación del endotelio (endotelitis), liberación de más citocinas inflamatorias, producción de fibrina a partir del fibrinógeno, agregación plaquetaria y microtrombosis pulmonar y en otros órganos y también trombosis en grandes vasos (algunos investigadores lo han llamado coagulación intersticial diseminada en vez de coagulación intravascular diseminada). Este nuevo hallazgo sugiere que puede haber otro culpable que es el más mortal y no la propia neumonía como tal. Se han descubierto pues los trastornos de la coagulación que también puede desempeñar un papel importante en la COVID-19 letal. La fisiopatología de la coagulopatía es compleja en estos casos y obedece a la interrelación entre elementos celulares y plasmáticos del sistema hemostático con componentes de la respuesta inmunitaria innata. Induce la producción de citocinas junto con la expresión de factor tisular. El aumento de citocinas puede ser la causa de la inflamación pulmonar y el deterioro del intercambio gaseoso, que a su vez estimularía la fibrinolisis pulmonar y produciría el incremento del dímero D. Además, el aumento de la expresión de factor tisular es un importante activador del sistema hemostático. Finalmente, la activación del endotelio, las plaquetas y otros elementos leucocitarios también van a producir un desequilibrio en la producción de trombina, con el consiguiente depósito de fibrina que produce una microangiopatía y daño tisular. El dímero D aumenta por degradación de la fibrina. Se produce trombocitopenia. Los primeros resultados de las autopsias muestran coágulos muy dispersos en múltiples órganos. Aparece la formación de coágulos en todas partes: coágulos de vasos grandes, incluida la trombosis venosa profunda (TVP) en las piernas y la embolia pulmonar (EP) en los pulmones; corazón, coágulos en las arterias, que causan accidentes cerebrovasculares y pequeños coágulos en pequeños vasos sanguíneos en órganos de todo el cuerpo.(9-20)
La activación de la cascada del complemento no solo causa daño endotelial directamente, sino que además recluta leucocitos a través de la formación de C3a y C5a, responsables de una liberación local masiva de citocinas proinflamatorias como la interleucina IL -1, IL-6, IL-8 e interferón-γ. Dentro de esta respuesta inmune masiva del huésped, los linfocitos, los macrófagos residentes, los monocitos y los neutrófilos ejercen sus potentes funciones proinflamatorias, causando lesiones severas adicionales en el tejido colateral y daño masivo de las células epiteliales endoteliales y alveolares vasculares y trombosis microvascular. Las implicaciones funcionales de esta peculiar patogénesis del síndrome de distress respiratorio agudo (SDRA) incluyen un empeoramiento progresivo de los desequilibrios de ventilación / perfusión y una pérdida de reflejos de vasoconstricción hipóxica, con un componente marcado de trombosis pulmonar microvascular, como lo sugieren las elevaciones de lactato deshidrogenasa, la proteína C reactiva y el dímero D. Además más recientemente se plantea que el mayor factor agresor en estos pacientes no es la neumonía como tal, sino la infección secundaria bacteriana con sepsis que se generaliza y la destrucción de hematíes, liberación de hemoglobina con separación del grupo hem y los enlaces capaces de captar el oxígeno lo que explica la hipoxemia severa sin un daño pulmonar tan evidente en un gran número de casos, aumento del hierro libre (el hierro liberado en la circulación es tan tóxico que causa un poderoso daño oxidativo a los pulmones) y la ferritina. Estos últimos producen severos daños en diferentes órganos.(9-20)
Es afectada la inmunidad nata de la defensa del organismo, fundamentalmente los macrófagos que son invadidos por las partículas virales, se reproducen dentro y terminan siendo destruidos. Posteriormente se afecta la inmunidad adaptativa, que es específica para cada patógeno. Están los anticuerpos, proteínas que han recibido un retrato del virus: un fragmento de la secuencia de su genoma llamada antígeno. Cuando encuentran ese fragmento, que puede ser una de las proteínas que recubren al virus, se unen a ella y evitan así que la partícula viral contagie a otra célula e inician el proceso para destruirla. Se producen primero anticuerpos IgM (inmunoglobulina M) que son los primeros en acudir, pero también los menos específicos. Una segunda oleada llega con los IgG (inmunoglobulina G), cuyo conocimiento y afinidad por el virus es mayor. Se sabe que las IgM aparecen entre 7 y 12 días después de la aparición de los primeros síntomas de COVID-19, los anticuerpos IgG empiezan a ser detectables a partir del día 14. Por otro lado están los linfocitos T que son afectados e inactivados por el virus.(9-20)
El proceso inflamatorio se disemina en el organismo contribuyendo pues a la afectación multiorgánica, estado crítico generalmente irreversible sobre todo en pacientes con comorbilidades y provoca la muerte.(21,22)
- SARS CoV-2 y sus efectos en las ECNT. Riesgo mayor de mortalidad
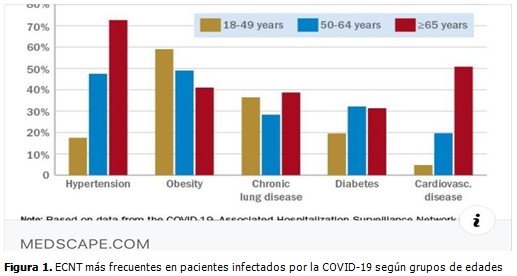
Desde el comienzo y la expansión de la epidemia por la COVID-19 hasta constituirse una verdadera pandemia, viene señalándose por los investigadores en diferentes publicaciones y medios de información sobre este tema, que la mayor mortalidad ocurre en pacientes mayores de 60 años, así como en los portadores de ECNT tales como la hipertensión arterial (HTA), enfermedades cardiovasculares (ECV), obesidad, diabetes mellitus (DM), enfermedad renal crónica (ERC), pacientes con neoplasias (N), pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y asma bronquial (AB) de larga fecha, pacientes con enfermedades hepáticas crónicas (EHC) y otras crónicas producidas por trastornos de la inmunidad donde se incluyen algunas reumáticas y neurológicas. Medscape en una recopilación de información de estudios hasta el momento (The New England Journal of Medicine, Lancet Respiratory Medicine, and Mayo Clinic Proceedings) ilustra la frecuencia de asociación de ECNT en grupos de edades como comorbilidades en pacientes con COVID-19 que contribuyen a la evolución grave y crítica de los casos y a la mayor mortalidad, también señalado por investigadores chinos.(23) (Figura 1).
En la información diaria del comportamiento epidemiológico de la COVID-19 en Cuba, el Dr. Francisco Durán, Director del Instituto Nacional de Higiene Epidemiología y Microbiología de la Habana, hace referencia a las comorbilidades en los casos graves, críticos y fallecidos como factor que incrementa la mortalidad en estos casos sobre todo en mayores de 60 años, comportándose muy similar a los datos ofrecidos por Medscape. Toda la información se recoge en los 50 días de epidemia en Cuba publicado por Cubadebate.(24, 25)
- Hipertensión arterial y otras enfermedades cardiovasculares
La HTA y las ECV constituyen riesgo para la letalidad por la infección y más aún si tienen asociada DM y la edad es superior a 65 años. Si se recuerda la patogenia expuesta, estos pacientes sufren afectación miocárdica y lesión vascular, trastornos de la coagulación con formación de trombos y fenómenos embólicos, todo lo cual empeora el curso de estas afecciones, aumenta la tensión arterial, da arritmias cardiacas, episodios coronarios agudos e insuficiencia cardiaca con choque cardiogénico. El electrocardiograma (ECG) y ecocardiograma de los pacientes de un estudio reveló supradesnivel del segmento ST, fracción de eyección del ventrículo izquierdo disminuida, poca movilidad de las paredes y en las angiografías tenían signos obstructivos con elevación de troponina y el dímero D. La lesión miocárdica en pacientes con COVID-19 podría deberse a ruptura de la placa, tormenta de citoquinas, lesión hipóxica, espasmo coronario, microtrombos o lesión endotelial o vascular directa. Se demostró edema intersticial miocárdico en la resonancia magnética en tales pacientes.(26) Están descritos también eventos cerebrovasculares(26-37) y en un porciento no despreciable la hipotensión arterial, que podría explicarse por la acción directa del virus o por el incremento de citoquinas proinflamatorias.(15)
- Afectación neurológica y accidentes cerebrovasculares
Es necesaria la consideración de un estudio retrospectivo de 214 pacientes con SARS-CoV-2, en tres hospitales de Wuhan (China). El 36,4 % de los pacientes presentaron manifestaciones neurológicas, donde predominó la afectación al sistema nervioso central (24,8 %) seguida por el daño al músculo esquelético (10,7 %) y al sistema nervioso periférico (8,9 %). (36) Las manifestaciones neurológicas más comunes fueron mareos (16,8 %), dolor de cabeza (13,1 %) y encefalopatía (2,8 %). Los signos y síntomas periféricos más comunes fueron anosmia (5,1 %), disgeusia (5,6 %) y lesión muscular (10,1 %, detectada por creatina quinasa elevada). Se cita también por los investigadores el empeoramiento de enfermedades neurológicas crónicas con base inmune. El accidente cerebrovascular complicó la infección por COVID-19 en el 5,9 % de los pacientes, con una mediana de 10 días después del inicio de los síntomas. Los pacientes con accidente cerebrovascular eran adultos mayores, tenían más comorbilidades cardiovasculares y la neumonía fue más grave. Los mecanismos del accidente cerebrovascular, según dichos autores, pueden variar y podrían incluir hipercoagulabilidad por enfermedad crítica y cardioembolismo relacionado con el virus.(36) La enfermedad cerebrovascular ha sido descrita en medio de la pandemia por SARS-CoV-2 como parte de las manifestaciones neurológicas no solo en pacientes añosos y con factores de riesgo vascular, sino se destaca en pacientes entre 30 y 49 años con ictus de grandes vasos que pueden ensombrecer el pronóstico y es de significativa importancia tenerle en cuenta, aunque no tenemos aún el reporte de muchas casuísticas.(37-39)
- SARS CoV 2 y diabetes tipo 2
La diabetes mellitus (DM) es una afección crónica con complicaciones multisistémica y está asociada con una forma grave de la enfermedad por coronavirus (COVID-19). La diabetes mellitus es una de las principales causas de morbilidad en todo el mundo y se prevé que aumente sustancialmente en las próximas décadas. Sabemos que las personas con diabetes tienen un mayor riesgo de infecciones bacterianas, micóticas, parasitarias y virales. Todavía no se conoce si las personas con DM son más susceptibles a padecer la COVID-19; pero varios estudios han informado un mayor riesgo de COVID-19 grave en pacientes diabéticos. Las personas diabéticas tienen un mayor riesgo de infecciones respiratorias debido a la presencia de un sistema inmune comprometido, especialmente la inmunidad innata. Incluso la hiperglucemia transitoria puede afectar temporalmente las respuestas inmunes innatas a la infección. En estudio con metanálisis, se planteó la hipótesis de que ACE2 puede ser el pionero clave de la gravedad de COVID-19 en individuos diabéticos. Las respuestas de citocinas proinflamatorias disfuncionales en pacientes diabéticos también podrían ser la causa subyacente de COVID-19 grave. Se ha demostrado que los pacientes diabéticos tienen un nivel elevado de citocinas proinflamatorias, en particular IL-1, IL-6 y factor de necrosis tumoral TNF α. Dos proteínas receptoras de coronavirus, enzima convertidora de angiotensina 2 (ACE2) y Dipeptidyl Peptidase -4 (DPP4) también son transductores establecidos de señales metabólicas y vías que regulan la inflamación, fisiología renal y cardiovascular y homeostasis de glucosa. Esto indica que la DM es un marcador de mal pronóstico potencial.(39) Otro estudio de 174 pacientes que ingresaron en el Hospital Wuhan Union desde el 10 de febrero de 2020 hasta el 29 de febrero de 2020 seleccionados, cuya única comorbilidad fue la diabetes, encontró los niveles séricos de inflamación (biomarcadores relacionados), tales como IL 6, proteína C reactiva, ferritina, dímero D y fueron significativamente mayores ( P < 0,01) en los pacientes diabéticos en comparación con otra serie de pacientes que no lo eran lo que sugiere que los pacientes con diabetes son más susceptibles a una tormenta inflamatoria que eventualmente conduce a un rápido deterioro de COVID-19.(40) Dado que la infección viral puede causar una fluctuación aguda del nivel de glucosa en sangre de los pacientes con diabetes, lo que afecta negativamente su recuperación, existe una razón para sospechar que la diabetes combinada con la neumonía por SARS CoV-2 puede formar un círculo vicioso, lo que es perjudicial para el pronóstico de la COVID-19. Las dosis de insulina aumentaron después de que los pacientes se infectaron con SARS CoV-2, lo que demuestra que el virus tiene un impacto en el metabolismo de la glucosa. La desregulación del metabolismo de la glucosa agrava la diabetes y luego afecta la gravedad de la neumonía.(41) Otros estudios encontraron que la inmunotinción de la proteína ACE2 es fuerte en los islotes pancreáticos, pero débil en los tejidos exocrinos, lo que significa que el coronavirus puede causar diabetes al dañar seriamente los islotes en pacientes que no lo eran, así como empeorar la diabetes en los ya diagnosticados al disminuir considerablemente las reservas insulínicas.(42,43)
Otras publicaciones señalan que la diabetes mellitus tipo 2, la obesidad y la hipertensión son las comorbilidades más comunes y asociadas en pacientes con infecciones por coronavirus. La evidencia emergente demuestra un importante vínculo metabólico y endocrino directo con el proceso de la enfermedad viral. Estos pacientes tienen un estado de inflamación metabólica, según los investigadores, que los predispone a una liberación aumentada de citocinas al ser infectados por la COVID-19. En el páncreas, la unión del coronavirus del SARS-CoV 2 a su receptor ACE2, daña los islotes y reduce la liberación de insulina, ya señalado anteriormente por otros investigadores. La COVID-19 no es principalmente una enfermedad metabólica, pero el control metabólico de la glucosa, los niveles de lípidos y la presión arterial son claves en estos pacientes y están interrelacionados, siendo indicadores de mal pronóstico.(43-45)
- El paciente con cáncer
Las personas con cáncer forman parte de los grupos vulnerables y de mayor riesgo en esta pandemia de la COVID-19. Aunque por el momento hay pocos datos sobre la infección en estos pacientes, los que ya se tienen sugieren un mayor riesgo de complicaciones en pacientes en tratamiento, sobre todo si han recibido quimioterapia o se han realizado cirugías oncológicas en el mes previo a contraer la infección. En estudios revisados se encontró que los pacientes con cáncer tenían un mayor riesgo de eventos graves (un punto final compuesto, definido como el porcentaje de pacientes que ingresaron a la unidad de cuidados intensivos y requirieron ventilación invasiva o que murieron) en comparación con aquellos sin cáncer (39 % v 8 %; razón de riesgo (39% v 8%, HR: 5.34; IC 95%, 1.80 a 16.18; P=0026). Este mismo autor revisó estudios y encontró que la prevalencia global combinada de cáncer en pacientes con COVID-19 en estos estudios fue del 2,0 % (IC del 95 %, 2,0 % a 3,0 %; I 2 = 83,2 %). En un análisis de subgrupos adicional basado en el tamaño de la muestra, se encontró que en los estudios con un tamaño de muestra <100, la prevalencia fue ligeramente mayor, al 3,0 % (IC 95 %, 1,0 % a 6,0 %), pero en estudios más grandes, con un tamaño de muestra > 100, encontramos una prevalencia general más baja de 2,0 % (IC 95 %, 1,0 % a 3,0 %).(46)
En respuesta a la pandemia de COVID-19, muchos centros de cáncer importantes han implementado políticas tales como la detección de síntomas e historial de viaje de COVID-19 a todos los pacientes, el personal y los proveedores, minimizando las visitas de seguimiento y las admisiones; pero recomiendan no suspender los tratamientos oncológicos a pesar de que originan inmunodepresión en los pacientes.(47-50) Aún no tenemos investigaciones publicadas en Cuba. A medida que la evidencia continúa aumentando, debemos esforzarnos por responder las preguntas clínicas sin respuesta. En general, la evidencia actual revisada sobre la asociación entre el cáncer y COVID-19 sigue sin ser concluyente. Sin embargo un artículo publicado(49) concluye que los pacientes con cáncer muestran condiciones deterioradas y malos resultados de la infección con COVID-19. Se recomienda que los pacientes con cáncer que reciben tratamientos antitumorales deban evitar tratamientos que causan inmunosupresión o sus dosis disminuidas en caso de COVID-19 coinfección. Resultan interesantes los resultados de un estudio(48) que indica que los fumadores, especialmente los exfumadores, pueden ser más susceptibles a la COVID-19 y tener vías de infección diferentes a las de los no fumadores. Por lo tanto, el historial de tabaquismo puede proporcionar información valiosa para identificar la población susceptible y estandarizar el régimen de tratamiento.
- Enfermedades respiratorias crónicas
Los más afectados y constituyen grupos vulnerables con mortalidad elevada por el SARSCov-2 son los que padecen enfermedad pulmonar obstructiva crónica (EPOC) y el asma bronquial de larga evolución con daños anatómicos y funcionales. Desarrollan insuficiencia respiratoria hipercapnica. Los investigadores John J. Marini, profesor de medicina en la Universidad de Minnesota e intensivista en el Regions Hospital en Minneapolis / St. Paul y Luciano Gattinoni de la Universidad Médica de Gotinga, en Alemania, plantean que el problema para estos pacientes no solo radica en los cambios anatómicos de las unidades respiratorias de los pulmones, sino también en las legiones de vasos sanguíneos que transportan la sangre a través de ellos. Normalmente, cuando una parte del pulmón se daña, los pequeños vasos sanguíneos se contraen para redirigir la sangre a áreas del pulmón que aún funcionan. Este mecanismo protege al cuerpo de una caída repentina de oxígeno. Pero en pulmones ya dañados como las patologías señaladas con insuficiencia respiratoria crónica y a elementos de hipertensión pulmonar, esto no puede funcionar así. Tener en cuenta la tormenta de marcadores inflamatorios y los trastornos vasculares y de la coagulación señalados en la patogenia de la enfermedad. Por ello en conclusión se reporta una mortalidad elevada entre 90 y 96 % en los pacientes con SARS Cov 2.(32, 51)
CONSIDERACIONES FINALES
La primeros veinte años que con lo que ya cuenta el siglo XXI se han caracterizado presentar una problemática de salud con afectación a escala mundial, de la que no está exenta Cuba debido a la aparición de enfermedades infecciosas emergentes y reemergentes, resistencia microbiana, aumento de la incidencia y las tasas de prevalencia de las enfermedades crónicas no transmisibles, aumento de la incidencia del cáncer y farmacorresistencia en la tuberculosis y el VIH/sida. Los estimados de la OMS son realmente alarmantes y preocupantes y obliga a todos los estados a establecer estrategias en salud para enfrentar esta situación. Hoy la OMS alerta sobre el incremento aún mayor para la presente década que comienza.
Asociado a esta problemática, el nuevo coronavirus, COVID-19, ya constituye una pandemia y el número de casos crece vertiginosamente por días.(52) La mortalidad igualmente es elevada y se concentra fundamentalmente en mayores de 60 años y con ECNT asociadas, donde tiene efectos devastadores descritos en el presente artículo. Además en los gerontes se presentan manifestaciones atípicas como: febrícula, adinamia, marcada astenia, síntomas confesionales sin síntomas respiratorios plenos y mayor deterioro cognitivo en pacientes con demencia que deben tenerlo presente los profesionales que se enfrentan a este grupo etáreo.(53)
La aparición de una enfermedad infecciosa humana causada por un patógeno nuevo subraya el desafío de las enfermedades infecciosas emergentes y la importancia de una preparación sostenida para enfrentarlo. Este ambiente en evolución trae aparejado el miedo, la desinformación y muchas incógnitas que aún a estas alturas quedan por dilucidar con futuras investigaciones, pero sin lugar a dudas incrementa la mortalidad por ECNT y en la población mayor de 60 años.
Conflicto de intereses: el autor declara la no existencia de conflictos de intereses relacionados con el estudio.
Contribución de los autores:
El autor expone que la idea conceptual, el análisis estadístico, la revisión de la literatura y la escritura del artículo corresponden a su autoría.
Financiación: Hospital General Docente Enrique Cabrera. La Habana.
REFERENCIAS BIBLIOGRÁFICAS
- Organización Mundial de la Salud. Noticias ONU. Retos de salud urgentes para la próxima década según la OMS [Internet]. Ginebra: OMS; 2010 [citado 1 Mar 2020]. Disponible en: https://teresaperez.net/2020/01/21/retos-de-salud-urgentes-para-la-proxima-decada-segun-la-oms/ [Buscar en Google Scholar]
- Serra MA, Serra M, Viera M. Las enfermedades crónicas no transmisibles: magnitud actual y tendencias futuras. Finlay [revista en Internet]. 2018 [citado 23 Abr 2020];8(2):[aprox. 8p]. Disponible en: http://revfinlay.sld.cu/index.php/finlay/article/view/561 [Buscar en Google Scholar]
- Ministerio de Salud Pública. Anuario Estadístico de Salud 2019 [Internet]. La Habana: Dirección Nacional de Estadísticas; 2020 [citado 15 Abr 2020]. Disponible en: http://bvscuba.sld.cu/anuario-estadistico-de-cuba/ [Buscar en Google Scholar]
- OPS/OMS. Agenda de Salud Sostenible para las Américas 2018-2030. Objetivo 9: Enfermedades no transmisibles [Internet]. Ginebra: OMS; 2020 [citado 15 Abr 2020]. Disponible en: https://www.paho.org/es/agenda-salud-sostenible-para-americas-2018-2030/agenda-salud-sostenible-para-americas-2018-2030-6 [Buscar en Google Scholar]
- Wang D, Hu B, Hu Ch, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020;323(11):1061-9 [Buscar en Google Scholar]
- Burke RM, Midgley CM, Dratch A, Fenstersheib M, Haupt T, Holshue M, et al. Active Monitoring of Persons Exposed to Patients with Confirmed COVID-19 - United States, January-February 2020. Morb Mortal Wkly Rep. 2020;69(9):245-6 [Buscar en Google Scholar]
- Organización Mundial de la Salud. Coronavirus disease (COVID-19) technical guidance [Internet]. Ginebra: OMS; 2020 [citado 1 May 2020]. Disponible en: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance [Buscar en Google Scholar]
- Bornstein S, Dalan R, Hopkins D, Mingrone G, Boehm B. Endocrine and metabolic link to coronavirus infection. Nature Reviews Endocrinology. 2020;16(6):1-2 [Buscar en Google Scholar]
- Neha M. The Great Invader: How COVID-19 Attacks Every Organ [Internet]. New York: Medscape; 2020 [citado 23 Abr 2020]. Disponible en: https://www.medscape.com/viewarticle/929284?nlid=135262_3243&src=WNL_mdplsfeat_200428_mscpedit_imed&uac=226682DK&spon=18&uac=226682DK&spon=18&uac=226682DK&spon=18&uac=226682DK&spon=18&uac=226682DK&spon=18&uac=226682DK&sfa=18&imp [Buscar en Google Scholar]
- Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417-18 [Buscar en Google Scholar]
- Accinelli RA, Xu CM, Yachachin JM, Cáceres JA, Tafur KB, Flores RG, et al. COVID-19: La pandemia por el nuevo virus SARS-CoV-2. Rev Peru Med Exp Salud Pública [revista en Internet]. 2020 [citado 17 May 2020];37(2):[aprox. 8p]. Disponible en: https://rpmesp.ins.gob.pe/index.php/rpmesp/article/view/5411 [Buscar en Google Scholar]
- Ruiz A, Jiménez M. SARS-CoV-2 y pandemia de síndrome respiratorio agudo (COVID-19). Ars Phar Nor [revista en Internet]. 2020 [citado 23 Mar 2020];61(1):[aprox. 8p]. Disponible en: https://revistaseug.ugr.es/index.php/ars/article/view/15177 [Buscar en Google Scholar]
- Bender JE, León R, Mendieta MD. Enfermedad cerebrovascular y COVID-19. Anales de la Academia de Ciencias de Cuba [revista en Internet]. 2020 [citado 29 Abr 2020];10(2):[aprox. 10p]. Disponible en: http://www.revistaccuba.cu/index.php/revacc/article/view/802 [Buscar en Google Scholar]
- Trilla A. Respuesta inmunitaria contra el coronavirus [Internet]. Madrid: La Vanguardia; 2020 [citado 1 May 2020]. Disponible en: https://www.lavanguardia.com/vida/20200304/473962317182/coronavirus-respuesta-inmunitaria-experto-organismo-claves.html [Buscar en Google Scholar]
- García RA, Rivero L, Aroche R, Aldama LI, Hernández M. COVID-19: en torno al sistema cardiovascular. Anales de la Academia de Ciencias de Cuba [revista en Internet]. 2020 [citado 29 Abr 2020];10(2):[aprox. 15p]. Disponible en: http://www.revistaccuba.sld.cu/index.php/revacc/article/view/782 [Buscar en Google Scholar]
- Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844-7 [Buscar en Google Scholar]
- Hoffmann M, Kleine H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271-80 [Buscar en Google Scholar]
- Brooks M. Datos más sólidos de lesión miocárdica en COVID-19 [Internet]. New York: Medscape; 2020 [citado 23 May 2020]. Disponible en: https://espanol.medscape.com/verarticulo/5905339?src=mkm_latmkt_200429_mscmrk_escoronavirus_nl&uac=226682DK&impID=2362787&faf=1 [Buscar en Google Scholar]
- Ciceri F, Beretta L, Scandroglio AM, Colombo S, Landoni G, Ruggeri A, et al. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Critical Care Resuscitation [revista en Internet]. 2020 [citado 2 Jun 2020];12(3):[aprox. 10p]. Disponible en: https://ccr.cicm.org.au/config/cicm-ccr/media/PDF/June-COVID-19/CCR_Landoni120_June_v6.pdf [Buscar en Google Scholar]
- Mehta P, McAuley DF, Brown M, Sánchez E, Tattersall R, Manson JJ. Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1-10 [Buscar en Google Scholar]
- Rodríguez AJ, Cardona JA, Gutiérrez E, Villamizar R, Holguín Y, Escalera JP, et al. COVID-19. Clinical, laboratory and imaging features of COVID-19: A systematic review and meta-analysis. Travel Medicine Infectious Disease [revista en Internet]. 2020 [citado 29 Abr 2020];34(2):[aprox. 10p]. Disponible en: https://doi.org/10.1016/j.tmaid.2020.101623 [Buscar en Google Scholar]
- Paules CI, Marston HD, Fauci AS. Coronavirus Infections—More Than Just the Common Cold. JAMA. 2020;323(8):707-8 [Buscar en Google Scholar]
- Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, et al. Prevalence of comorbidities in the Novel Wuhan Coronavirus (COVID-19) infection: a systematic review and meta-analysis. J Inter Infect Dis. 2020;94(10):91-5 [Buscar en Google Scholar]
- Carmona E, Fariñas L. Cuba en Datos: A 50 días de la COVID-19 en el país [Internet]. La Habana: CUBADEBATE; 2020 [citado 2 May 2020]. Disponible en: http://www.cubadebate.cu/especiales/2020/04/30/cuba-en-datos-a-50-dias-de-la-covid-19-en-el-pais/ [Buscar en Google Scholar]
- Figueredo O, Padrón A, Carmona E. COVID-19 en Cuba: El pico se adelanta, ¿qué dicen los modelos matemáticos y cómo interpretarlos? [Internet]. La Habana: CUBADEBATE; 2020 [citado 2 May 2020]. Disponible en: http://www.cubadebate.cu/especiales/2020/04/27/COVID-19-en-cuba-el-pico-se-adelanta-que-dicen-los-modelos-matematicos-y-como-interpretarlos/ [Buscar en Google Scholar]
- Bangalore S, Sharma A, Slotwiner A, Yatskar L, Hararri R. ST-Segment Elevation in Patients with COVID-19 — A Case Series. N Engl J Med. 2020;382(1):2478-80 [Buscar en Google Scholar]
- Villanueva I, Ramírez R, Montejo J, Rodelo J, Puello L, Vélez MA, et al. COVID-19 e hipertensión arterial: ¿existe evidencia para suspender antagonista sistema renina angiotensina?. Rev Colom Nefrol [revista en Internet]. 2020;7 Suppl 2:[aprox. 10p]. Disponible en: https://173.236.196.226/index.php/rcn/article/view/405 [Buscar en Google Scholar]
- Vega CP, Hughes S. ¿Cuál es el vínculo entre los inhibidores RAAS y COVID-19? [Internet]. New York: Medscape; 2020 [citado 20 May 2020]. Disponible en: https://www.medscape.org/viewarticle/929633?nlid=135270_2705&src=wnl_cmemp_200501_mscpedu_imed&uac=226682DK&impID=2367085&faf=1. [Buscar en Google Scholar]
- Suero LE, Valencia SE, Jara GD, Quishpe AC. La mejor evidencia científica, ante la pandemia de SARS-Cov-2. Mediciencias UTA [revista en Internet]. 2020 [citado 16 May 2020];4(2):[aprox. 25p]. Disponible en: https://medicienciasuta.uta.edu.ec/index.php/MedicienciasUTA/article/download/344/218 [Buscar en Google Scholar]
- Chen X, Hu W, Ling J, Mo P, Zhang Y, Jiang Q, et al. Hypertension and Diabetes Delay the Viral Clearance in COVID-19 Patients. Med Rxiv [revista en Internet]. 2020 [citado 27 Abr 2020];1(1):[aprox. 8p]. Disponible en: https://doi.org/10.1101/2020.03.22.20040774 [Buscar en Google Scholar]
- Li B, Yang J, Zhao F, Zhi L, Wang X, Liu L, et al. Prevalencia e impacto de las enfermedades cardiovasculares y metabólicas en COVID-19 en China. Clin Res Cardiol [revista en Internet]. 2020 [citado 27 Abr 2020];109(10):[aprox. 25p]. Disponible en: https://link.springer.com/article/10.1007/s00392-020-01626-9 [Buscar en Google Scholar]
- Zhou F, Yu T, Du R, Fan G, Lui Y. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1-20 [Buscar en Google Scholar]
- Giralt A, Rojas JM, Leiva J. Relación entre COVID-19 e Hipertensión Arterial. Rev haban cienc méd [revista en Internet]. 2020 [citado 2 May 2020];19(2):[aprox. 10p]. Disponible en: http://www.revhabanera.sld.cu/index.php/rhab/article/view/3246 [Buscar en Google Scholar]
- McNamara D. COVID-19 relacionado con accidente cerebrovascular de grandes vasos en adultos jóvenes [Internet]. New York: Medscape; 2020 [citado 24 Abr 2020]. Disponible en: https://www.medscape.com/viewarticle/929345 [Buscar en Google Scholar]
- Alexander M. Presentaciones inusuales de COVID-19: nuestra ignorancia es profunda [Internet]. New York: Medscape; 2020 [citado 29 May 2020]. Disponible en: https://www.medscape.com/viewarticle/928929 [Buscar en Google Scholar]
- Mao L, Wang M, Chen S, He Q, Chang J, Hong C, et al. Neurological manifestations of hospitalized patients with COVID-19 in Wuhan, China: a retrospective case series study. MedRxiv [revista en Internet]. 2020;1(1):[aprox. 10p]. Disponible en: https://doi.org/10.1101/2020.02.22.20026500 [Buscar en Google Scholar]
- Bender J, León R, Mendieta M. Enfermedad cerebrovascular y COVID-19. Anales de la Academia de Ciencias de Cuba [revista en Internet]. 2020 [citado 29 Abr 2020];10(2):[aprox. 10p]. Disponible en: http://www.revistaccuba.cu/index.php/revacc/article/view/802 [Buscar en Google Scholar]
- Meziani F. Neurologic Features in Severe SARS-CoV-2 Infection. N Engl J Med. 2020;382(10):2268-70 [Buscar en Google Scholar]
- Yan L, Wan B, Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol. 2020;92(6):552-55 [Buscar en Google Scholar]
- Huang I, Lim MA, Pranata R. La diabetes mellitus se asocia con una mayor mortalidad y gravedad de la enfermedad en la neumonía por COVID-19: una revisión sistemática, un metanálisis y una metarregresión. Diabetes Metab Syndr. 2020;14(4):1-22 [Buscar en Google Scholar]
- Guo W, Li M, Dong Y, Zhou H, Zhang Z, Tian C, et al. La diabetes es un factor de riesgo para la progresión y el pronóstico de COVID-19. Diabetes Metab Res Rev. 2020;10(2):25-37 [Buscar en Google Scholar]
- Zhang Y, Cui Y, Shen M, Zhang J. Comorbid Diabetes Mellitus was Associated with Poorer Prognosis in Patients with COVID-19: A Retrospective Cohort Study. MedRxiv. 2020;10(2):25-37 [Buscar en Google Scholar]
- Drucker DJ. Infecciones por coronavirus y diabetes tipo 2 - caminos compartidos con implicaciones terapéuticas. Endocr Rev. 2020;4(1):39-47 [Buscar en Google Scholar]
- Bornstein SR, Dalan R, Hopkins D, Mingrone G, Boehm BO. Endocrine and metabolic link to coronavirus infection. Nat Rev Endocrinol. 2020;16(6):297-98 [Buscar en Google Scholar]
- Bello OY, Bahena JP. Predicting mortality attributable to SARS-CoV-2: A mechanistic score relating obesity and diabetes to COVID-19 outcomes in México. MedRxiv. 2020;10(2):45-54 [Buscar en Google Scholar]
- Aakash A, Sonali S, Tarang P, Rupak D. COVID-19 and Cancer: Lessons From a Pooled Meta-Analysis. JCO Global Oncology. 2020;6(2):557-9 [Buscar en Google Scholar]
- Liang W, Guan W, Chen R. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020;21(3):335-37 [Buscar en Google Scholar]
- Cai G. Bulk and single-cell transcriptomics identify tobacco-use disparity in lung gene expression of ACE2, the receptor of 2019-nCov. MedRxiv. 2020;10(2):367-9 [Buscar en Google Scholar]
- Sharpless NE. Respuesta sólida y rápida del NCI a la pandemia de la COVID-19 [Internet].Instituto Nacional del Cáncer; 2020 [citado 3 Abr 2020]. Disponible en: https://www.cancer.gov/espanol/noticias/temas-y-relatos-blog/2020/respuesta-nci-covid-19-cancer [Buscar en Google Scholar]
- Zhang L, Zhu F, Wang C, Wang J, Chen R, Jia P et al. Características clínicas de pacientes con cáncer infectados con COVID-19: un estudio de caso retrospectivo en tres hospitales en Wuhan, China. Annals of Oncology. 2020;20(12):234-40 [Buscar en Google Scholar]
- Infomed. ¿Qué están encontrando las primeras autopsias de los fallecidos por COVID-19? [Internet]. La Habana: Infomed; 2020 [citado 23 May 2020]. Disponible en: http://www.sld.cu/node?iwp_post=2020/05/28/Qué están encontrando las primeras autopsias de los fallecidos por COVID-19/1684185&iwp_ids=16_84185&blog=1_aldia [Buscar en Google Scholar]
- Serra MA. Infección respiratoria aguda por COVID-19: una amenaza evidente. Rev haban cienc méd [revista en Internet]. 2020 [citado 29 Abr 2020];19(1):[aprox. 5p]. Disponible en: http://www.revhabanera.sld.cu/index.php/rhab/article/view/3171 [Buscar en Google Scholar]
- Nieto C. Mayor vulnerabilidad y sintomatología atípica en pacientes mayores con COVID-19 [Internet]. New York: Medscape; 2020 [citado 23 Mar 2020]. Disponible en: https://espanol.medscape.com/verarticulo/5905380 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129